RESUMO
Fluidos são medicamentos usados
em pacientes veterinários capazes de produzir efeitos terapêuticos benéficos ou
efeitos nocivos dentro dos espaços intravasculares, intersticiais e
intracelulares do corpo. O design
individualizado de um plano de terapia de fluidos requer avaliação
cuidadosa do paciente e seleção direcionada de tipos de fluidos adequados, vias
de administração e taxas, juntamente com ajustes durante a terapia, adaptados
especificamente conforme a necessidade de fluidos e a resposta terapêutica
individual do paciente. Prescrições personalizadas de fluidos e monitoramento
vigilante do paciente ajudam a evitar a morbidade do paciente por deficiências
de fluidos corporais, excesso de fluidos e distúrbios eletrolíticos e dão
suporte a melhores resultados para o paciente. Essas diretrizes fornecem uma
visão geral da dinâmica dos fluidos dentro dos espaços do corpo, descrevem
vários tipos de fluidos e seus usos e descrevem recomendações para administração
para fins de ressuscitação, reidratação e manutenção. As diretrizes também
descrevem abordagens para terapia em pacientes anestesiados e reiterar as
recomendações de taxas reduzidas de fluidos nessa população. Além disso, as
diretrizes incluem estratégias práticas de terapia de fluidos para pacientes
com vários distúrbios comuns. O objetivo dessas diretrizes é ajudar os
profissionais veterinários a prescrever e administrar com segurança e eficácia
a terapia de fluidos para pacientes caninos e felinos.
Estas diretrizes e recomendações não devem ser
interpretadas como ditando um protocolo exclusivo, curso de tratamento ou
procedimento. Variações na prática podem ser garantido com base nas
necessidades do paciente individual, recursos e limitações exclusivas de cada
ambiente de prática individual. O suporte guiado por evidências para
recomendações específicas foi citado sempre que possível e apropriado. Outras
recomendações são baseadas na experiência clínica prática e em um consenso de
opinião de especialistas. Mais pesquisas são necessárias para documentar
algumas dessas recomendações. As aprovações e rotulagens de medicamentos são
atuais no momento da redação, mas podem mudar ao longo do tempo. Como cada caso
é diferente, os veterinários devem basear suas decisões nas melhores evidências
científicas disponíveis em conjunto com seu próprio conhecimento e experiência.
IRA (lesão renal aguda); CPP (plasma pobre em
crioprecipitado); RCP (ressuscitação cardiopulmonar); CRI (infusão de taxa
contínua); CRT (tempo de enchimento capilar); CSA (albumina específica para
cães); FWD (déficit de água livre); TFG (taxa de filtração glomerular); IO
(intraósseo); KCl (cloreto de potássio); SC (subcutâneo); TBI (lesão cerebral
traumática); TVI (volume total infundido); VTBI (volume a ser infundido).
Definições
Desidratação
— Condição na qual o corpo perde mais fluidos do que ingere, resultando em um
desequilíbrio de água e eletrólitos.
Euvolemia/euvolêmico—Equilíbrio
e distribuição normais da água corporal total.
Sobrecarga
de fluidos/intolerância a fluidos — Um espectro clínico que abrange
desde hipervolemia até edema com risco de vida e efusões cavitárias. A força
tarefa de diretrizes propôs que intolerância a fluidos pode ser o termo mais
apropriado para essa condição, pois esse termo descreve com mais precisão como
a quantidade de fluido necessária para sobrecarregar um paciente depende de sua
tolerância a uma determinada quantidade de fluidos. “Intolerância a fluidos”, portanto, abrange tanto sobrecarga iatrogênica quanto sobrecarga
devido a comorbidades subjacentes. No entanto, dado que “sobrecarga de
fluidos” ainda é amplamente utilizado e reconhecido na profissão médica
veterinária, será o termo principal usado nestas diretrizes para se referir a
esta condição.
Hipervolemia/hipervolêmico—Aumento
do volume de fluido dentro do espaço vascular. Hipertensão geralmente não é uma
indicação de hipervolemia (exceto quando doença renal está presente).
Hipovolemia/hipovolêmico—Diminuição
do volume de fluido dentro do espaço vascular.
Fluidos de
manutenção — Soluções cristaloides formuladas com concentrações de
eletrólitos para atender às necessidades diárias do paciente.
Fluidos de
reposição — Fluidos cristaloides destinados a repor fluidos corporais e
eletrólitos perdidos.
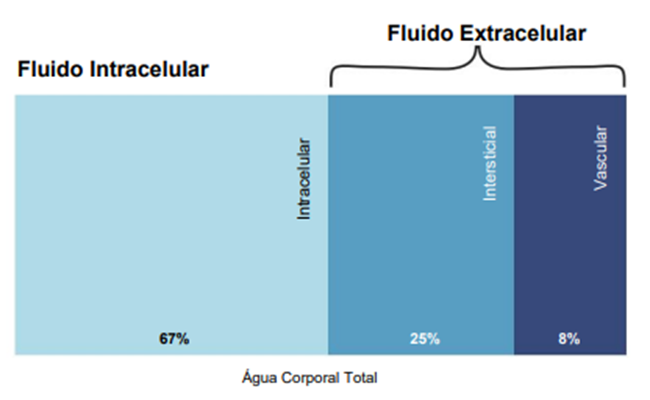
Água
corporal total — A quantidade total de água contida em três
compartimentos do corpo dos mamíferos: intracelular (67%) e extracelular (33%),
que é ainda dividida em espaços intersticial (25%) e vascular (ou
intravascular) (8%).
Seção 1:
Introdução
A terapia com fluidos é um aspecto comum do
atendimento ao paciente veterinário, necessária para uma ampla gama de
condições clínicas que abrangem desde casos relativamente leves (por exemplo,
ingestão voluntária inadequada de curto prazo devido a gastrite aguda) até
condições mais moderadas (por exemplo, doença renal crônica) e emergências com
risco de vida (por exemplo, perda substancial de volume e choque). Quando
prescrita e administrada corretamente, a terapia com fluidos pode ser um dos
tratamentos mais benéficos disponíveis na medicina veterinária. No entanto,
atingir os resultados terapêuticos desejados, em vez de administrar fluidos sem
efeito ou que piorem o problema, requer uma compreensão dos fatores
fisiológicos que influenciam o movimento do fluido corporal e o equilíbrio
eletrolítico. Refinar esse conhecimento para criar planos terapêuticos
personalizados para cada paciente pode ser desafiador, mas prova ser um esforço
satisfatório para melhorar a saúde do paciente.
Estas diretrizes oferecem uma visão geral da dinâmica
de fluidos do corpo e fornecem recomendações práticas para selecionar fluidos,
calcular taxas de administração e escolher rotas de administração em cães e
gatos para fins de ressuscitação, reidratação e manutenção. As diretrizes também
abrangem recomendações de terapia de fluidos para pacientes anestesiados,
pacientes com condições comuns e aqueles com distúrbios que apresentam desafios
especiais de terapia de fluidos. Além disso, estas diretrizes detalham os
parâmetros de monitoramento do paciente, destacam métodos para evitar
sobrecarga de fluidos, descrevem opções de administração de fluidos, e abordar
controvérsias e equívocos na terapia de fluidos.
Seção 2:
Princípios gerais da terapia de fluidos
Três principais conclusões
1. Os
fluidos são medicamentos e devem ser prescritos adequadamente para atingir os
objetivos terapêuticos desejados prontamente e minimizar as complicações;
2. Cada
compartimento de fluido corporal — intracelular, intersticial e intravascular —
pode exigir uma prescrição de fluido diferente, adaptada às necessidades
individuais do paciente;
3. Atribuir
arbitrariamente uma taxa ou dose de fluido pode contribuir para a morbidade e
mortalidade do paciente e levar à perda de metas de fluidoterapia.
Visão Geral
A terapia de fluidos envolve administrar fluidos
prescritos para restaurar a homeostase do fluido corporal de um paciente. Como
com qualquer medicamento, a farmacocinética e a farmacodinâmica de cada fluido
devem ser consideradas para atingir objetivos terapêuticos e minimizar
complicações. No entanto, a terapia de fluidos sozinha não pode corrigir todas
as anormalidades, e usar uma taxa de fluidos padronizada para todos os
pacientes pode resultar em morbidade do paciente (veja Caixa 1). Para
prescrever terapia de fluidos eficaz, os veterinários devem ter um entendimento
básico dos compartimentos de fluidos do corpo e como a água é distribuída entre
eles.
Caixa 1: Uma
taxa de fluído não serve para todos
Um equívoco
comum é que administrar fluidos em duas vezes a taxa de manutenção tratará
adequadamente a maioria dos pacientes veterinários que precisam de terapia de
fluidos. No entanto, essa abordagem pode ser inapropriada ou inadequada em
vários cenários, conforme mostrado nos exemplos a seguir:
·
Desidratação
intersticial. Usar uma taxa de administração de fluidos de manutenção duas
vezes maior levaria aproximadamente 33 horas para reidratar um paciente com 5%
de desidratação intersticial, muito mais do que as 12–24 horas recomendadas.
·
Uremia
devido à lesão renal aguda (LRA). O objetivo principal no tratamento da LRA é
garantir a perfusão renal adequada e corresponder à capacidade do rim de lidar
com volumes de fluidos. A taxa de
entrada de fluidos para pacientes normovolêmicos deve ser determinada com base
na saída de fluidos (consulte a Seção 5, Fluidoterapia em Pacientes
Doentes).
·
Intoxicações.
A administração de um volume de fluidos/ hora para forçar a diurese e a
produção de urina não aumenta a excreção de toxinas e pode resultar em
sobrecarga de líquidos. Por exemplo, embora alguns animais com toxicidade por
anti-inflamatórios não esteroides (AINEs) possam se beneficiar da terapia com
fluidos para tratar a desidratação ou a hipovolemia, altas taxas de fluidos
(também conhecidas como diurese forçada) não acelera a eliminação dos AINEs
porque a maioria deles são altamente ligados a proteínas.
Distribuição
de Fluidos e Fluxo Entre os Três Compartimentos Primários de Fluidos
Os três principais compartimentos corporais em
mamíferos contêm água. Os compartimentos de fluidos intracelular e extracelular
contêm 67% e 33% da água corporal total, respectivamente (Figura 1), e essas
seções são separadas por membranas celulares. O compartimento de fluidos
extracelular é ainda dividido em compartimentos intersticial (25% da água corporal
total, ou 75% da água corporal extracelular) e vascular (8% da água corporal
total, ou 25% da água corporal extracelular), e paredes capilares separam esses
espaços (Figura 1).
Figura 1 Distribuição normal de água
corporal
A ingestão de fluidos por qualquer via pode afetar os
compartimentos de fluidos corporais. Os fluidos administrados movem-se entre os
compartimentos com base em:
·
Tonicidade do fluido
·
Tonicidade do compartimento extracelular do
paciente
·
Tamanho de quaisquer macromoléculas no fluido
administrado
O sódio é o cátion mais abundante no fluido
extracelular e é a molécula que mais suporta a tonicidade extracelular. Um fluido administrado por via intravenosa
que contém a concentração do sódio semelhante à do compartimento de fluido
extracelular será redistribuída dentro de 45 min com base na porcentagem de
água corporal total de um compartimento; ou seja, em um animal normal, 25% do
fluido administrado permanecerá no espaço intravascular e 75% se moverá para o
espaço intersticial. O movimento do fluido através da membrana endotelial
depende do conteúdo do fluido administrado e da condição da membrana capilar do
paciente. A hipótese de Starling modificada descreve como o fluido se move
através da membrana capilar (Figura 2). A pressão hidrostática, a pressão
osmótica coloidal e a permeabilidade vascular influenciam o movimento do
fluido.
Figura 2
Hipótese de Starling modificada
Hipótese inicial modificada de fluxo de fluido
através da membrana capilar. Força de filtração = ([Pc - Pi ] -  [πp - πg]). Pc, Pressão hidrostática
capilar; Pi, Pressão hidrostática intersticial; pp, Pressão oncótica
plasmática; pi, Pressão oncótica intersticial; pg, Pressão oncótica do
glicocálice. Reimpresso de Silverstein DC e Hopper K, eds., Small Animal Critical
Care Medicine, 3ª ed., Waddell L., Pressão osmótica coloidal e osmolalidade, p.
1055, Elsevier (2022), com permissão da Elsevier.
[πp - πg]). Pc, Pressão hidrostática
capilar; Pi, Pressão hidrostática intersticial; pp, Pressão oncótica
plasmática; pi, Pressão oncótica intersticial; pg, Pressão oncótica do
glicocálice. Reimpresso de Silverstein DC e Hopper K, eds., Small Animal Critical
Care Medicine, 3ª ed., Waddell L., Pressão osmótica coloidal e osmolalidade, p.
1055, Elsevier (2022), com permissão da Elsevier.
Quando ocorre aumento da permeabilidade da membrana
capilar, aumento da pressão hidrostática intravascular ou diminuição da pressão
coloidosmótica plasmática, mais fluido isotônico pode passar para o interstício
ou cavidade corporal e causar edema tecidual, derrame ou ambos.
A administração de um fluido hipertônico IV fará com
que a água se mova dos espaços intersticial e intracelular para o espaço
intravascular. Isso pode ser desejável para ressuscitação rápida do volume
intravascular. No entanto, para que essa estratégia tenha sucesso, os espaços
intersticial e intracelular já devem estar adequadamente hidratados. Quando administrado
IV, um fluido hipotônico fará com que a água se mova do espaço extracelular
para o espaço intracelular, o que é uma abordagem adequada ao tratar um déficit
de água livre de soluto.
Terapia de
Fluidos Direcionada a Objetivos
A terapia de fluidos direcionada a objetivos requer a
criação de uma prescrição de fluidos que substitua os déficits de fluidos que
podem existir em cada compartimento de fluidos, usando as seguintes etapas:
1. Reconhecer
qual(is) déficit(s) do compartimento de fluidos existe(m);
2. Entenda
qual tipo de fluido e via de administração substituirão melhor cada déficit;
3. Calcule
a dose do fluido e a taxa de administração;
4. Monitorar
os pacientes quanto à resposta à terapia e sinais de complicações.
Avaliação de
Pacientes: Princípios Gerais Antes e Durante a Fluidoterapia
O compartimento de fluido extracelular (ou seja, os
espaços vascular e intersticial) deve ter volume adequado antes que os déficits
do compartimento de fluido intracelular possam ser abordados. Portanto, avalie
e aborde as alterações na homeostase do volume na seguinte ordem:
1. Avalie
o espaço do fluido intravascular avaliando:
·
Histórico do paciente;
·
Parâmetros de perfusão (mental, frequência
cardíaca, tempo de enchimento capilar, cor da membrana mucosa, temperatura das
extremidades, turgor da pele e qualidade do pulso);
·
Parâmetros monitorados (pressão arterial,
achados de eletrocardiograma);
·
Resultados dos testes laboratoriais (Tabela 1);
·
Achados de diagnóstico por imagem (Tabelas 1, 2
).
2. Avalie
o espaço intersticial avaliando:
·
Parâmetros de hidratação do paciente (Tabelas
3–5)
3. Avalie
o espaço intracelular avaliando:
·
Concentração de sódio do paciente
·
Déficit hídrico livre de soluto (FWD) (Caixa 2)
Caixa 2:
Cálculo do Déficit de Água Livre
Déficit de Água
Livre (DAL) em Litros (L) = [Na do Paciente/Na Desejado) -1] x (0,6 x Peso
[kg])
Exemplo:
Cão de 20,85 kg
Na
mensurado: 165 mEq
Na
desejado: 145 mEq
Déficit
de Água Livre (DAL) em Litros (L)= [165/145-1] x (0,6*20,85)= 1.725,52 mL
Esta
fórmula estima o volume de água livre necessário para retornar o estado de
saúde deste paciente com concentração sérica de Na ao normal (ou seja, 145
mEq/L). Para hipernatremia crônica, a concentração sérica de Na não deve ser
corrigida mais rapidamente do que 0,5 para 1 mEq/L/h
Ou seja: 165-145
= 20 horas para 1 mEq/L/h ao dobro de horas 40 horas se a meta for 0,5mEq/L/h
Taxa de fluido
desse paciente:
1.725,52/20
horas = 86,27 mL/hora agua pura em 20 horas ou
1.725,52/40
horas = 43,13 mL/hora agua pura em 40 horas
Se for ½ agua
pura e ½ NacL 0,9% = 0,45% o volume de mL/h dobra.
CASO Outro exemplo do artigo de
distúrbios de sódio
Para um paciente de 17,3 kg com concentração
sérica normal de Na de 145 mEq/L e concentração sérica atual de Na de 182
mEq/L:
Déficit hídrico = 0,6 x17,3 x([182/145] -1) =
2,65 L = 2.650 mL
Esta fórmula
estima o volume de água livre necessário para retornar o estado de saúde deste
paciente com concentração sérica de Na ao normal (ou seja, 145 mEq/L). Para
hipernatremia crônica, a concentração sérica de Na não deve ser corrigida mais
rapidamente do que 0,5 para 1 mEq/L/h. O paciente descrito anteriormente deverá
ter a hipernatremia corrigida de 182 mEq/L para 145 mEq/L em 37 a 74 horas.
Portanto, a taxa de fluido usando D5W deve ser de 36 a 72 mL/h (ou seja, 2.650
dividido por 37 ou 74). Se estiver usando NaCl a 0,45%, a taxa precisaria ser
de 72 a 144 mL/h, porque apenas metade do volume do fluido é água pura.
CASO
hipernatremia aguda
Um golden retriever macho castrado de 8 anos de
idade apresentou insolação. As informações úteis são as seguintes: peso
corporal 49 kg; temperatura 109,6 F; frequência cardíaca, 189 bpm com choque
hiperdinâmico. Os resultados dos testes diagnósticos iniciais foram os
seguintes: PCV 51%; PT 6,8 g/dL; eletrólitos: Na, 145 mEq/L; lactato, 5,9
mmol/L. O acompanhamento foi o seguinte: 10 horas após a admissão, a
concentração sérica de Na era de 168 mEq/L e o paciente desenvolveu uma
alteração na atividade. O cachorro também estava tornando-se levemente
hiperglicêmico (ou seja, concentração de glicose no sangue, 150–200 mg/dL).
Este paciente provavelmente está sofrendo de
perda aguda de água livre causada por evaporação, perda por insolação. O médico
sabe que o cão sofreu uma doença aguda e a alteração na concentração sérica de
Na é sintomático (início agudo da
alteração mental). Neste caso, é apropriado substituir o défice de água livre
mais rapidamente do que o recomendado 0,5 a 1,0 mEq/L/h. O primeiro passo é
calcular o déficit hídrico livre. Usando a equação clássica do déficit hídrico:
Déficit hídrico = 0,6 x Peso (kg) x
([concentração de Na do paciente/concentração normal de Na] – 1)
Para este cão de 49 kg com uma concentração
sérica de Na originalmente normal de 145 mEq/L e uma concentração sérica atual
de Na de 168 mEq/L, é a seguinte:
Déficit hídrico = 0,6 x 49 x ([168/145] -1) =
4,663 L = 4663 mL
Esta fórmula estima a quantidade de água livre
necessária para retornar a concentração sérica de Na ao normal do paciente (ou
seja, 145 mEq/L). No caso de hipernatremia crônica, esse volume não deve ser
administrado mais rapidamente do que 0,5 a 1,0 mEq/L/h. No entanto, este
paciente apresenta hipernatremia sintomática aguda. Portanto, esse paciente
recebeu 2.000 mL de água estéril por via intravenosa através de um cateter
central durante 2 horas. O restante do défice (2.663 L) foi corrigido ao longo
de 27 horas, a um ritmo horário de 100 mL/h.
Como o paciente estava desenvolvendo uma
síndrome de resposta inflamatória sistêmica e estava ficando hiperglicêmico, o
uso do D5W (solução com 5% de dextrose em água) foi considerado contraindicado;
como um cateter venoso central estava colocado, o médico optou pela
administração intravenosa de água estéril. Quando infundido através de um
cateter central, administrado por via intravenosa água estéril não causa
hemólise intravascular.
A fórmula de Adrogue´-Madias (ver Equação 4) que
calcula a alteração da concentração sérica de Na com a infusão de um litro de
determinado líquido também pode ser utilizada:
Alteração na concentração sérica de Na =
(concentração de Na + K em 1 L de solução – concentração sérica medida de
Na)/([0,6 x Peso (kg)] + 1).
No exemplo anterior de um cão de 49 kg e usando
D5W, a Equação 3 torna-se:
Alteração na concentração sérica de Na =
(0–168)/([0,6 x 49] + 1)
Alteração na concentração sérica de Na = -168/30,4
mEq/L
Alteração na concentração sérica de Na = -5,5
mEq/L
Esta fórmula indica que 1 L de D5W diminuirá a
concentração sérica de Na em 5,5 mEq/L. Para diminuí-lo para normal (ou seja,
145 mEq/L) de 168 mEq/L, (168–145)/5,5 ou 4.182 L de água estéril (porque este
paciente era hiperglicêmico e tinha cateter central) será necessário, com
metade do défice administrado mais rapidamente (ou seja, mais de 2 horas) em
fim de interromper os sinais clínicos, alterando a concentração de Na mais
rapidamente, e o descanso concedido por um longo período de tempo.
Se o médico
preferir usar NaCl a 0,45% (concentração de Na, 77 mEq/L), a taxa deve ser
ajustado porque apenas 50% deste fluido é realmente água livre. O paciente,
portanto, precisaria receber um volume e uma taxa de infusão substanciais que
pudessem contribuir para o edema cerebral. Por esta razão, o fluido de menor
tonicidade (e, portanto, menor volume de líquido) é sempre recomendado.
GUILLAUMIN, J; DiBARTOLA, S. Disorders of sodium
and water homeostasis. Vet Clin Small Anim. 2016.; GUILLAUMIN, J; DiBARTOLA, S.
A quick reference on hyponatremia. Vet Clin Small Anim. 47 (2017) 213-217.;
GUILLAUMIN, J; DiBARTOLA, S. A quick reference on hypernatremia. Vet Clin Small
Anim. 47 (2017) 209-212.
Substituir déficits
e monitorar a resposta
Para substituir déficits no espaço do fluido
extracelular (ou seja, déficits no espaço do fluido vascular e intersticial):
·
Administre um fluido cristaloide isotônico
tamponado que contenha uma concentração de sódio semelhante à do paciente;
·
Para rápida reposição de volume intravascular,
um cristaloide hipertônico, uma solução coloidal ou ambos também podem ser
usados;
·
Monitore de perto os parâmetros do paciente até
que a homeostase do fluido seja alcançada e mantida (Tabelas 1, 3–5);
·
O monitoramento também pode ser alcançado
avaliando a variação relativa na veia
cava caudal durante um ciclo respiratório usando ultrassonografia e calculando
o Índice de Colapsibilidade da Veia Cava Caudal. Veja a Tabela 6 para
algumas condições que apresentam desafios adicionais no tratamento das
necessidades individuais do compartimento de fluidos. Para mais informações
sobre como lidar com os desafios da terapia de fluidos, veja a Seção 5, Terapia
de Fluidos em Pacientes Doentes.
Tabela 1
Avaliação do volume intravascular
|
Critério
|
Hipovolemia
|
Hipervolemia
|
|
Histórico do
Paciente
|
Vomito, diarreia,
diminuição da ingestão de água, anorexia ou hiporexia, sinais respiratórios,
febre, perda de sangue e hemorragia
|
Overdose de fluido
iatrogênico, polidipsia, intoxicação por sal, administração de agente
osmótico
|
|
Resultados do exame
físico
|
Veja na tabela 2
Caso ocorra
desidratação severa (>12%). Pode ver evidência de hemorragia sangramento,
epistache, etc)
|
Limitação da
qualidade do pulso, novo sopro cardíaco, sons pulmonares úmidos, secreção
ocular e nasal, distensão da veia jugular, edema periférico
|
|
Pressão sanguínea e
eletrocardiograma descobertos
|
Hipotensão,
arritmia
|
Arritmia
|
|
Resultado de testes
laboratoriais
|
Hiperlactatemia,
acidose metabólica, anemia aguda, hipoproteinemia (talvez secundaria a
hemorragia)
|
Hemodiluição de
volume de células compactadas, ureia e nitrogênio no sangue e eletrólitos.
|
|
Resultados
diagnóstico por imagem (rx, US, TC)
|
Microcardia,
pequena veia cava torácica caudal, índice colapsidade da veia cava torácica
caudal > 27%
|
Distenção venosa
abdominal, índice colapsidade da veia cava torácica caudal > 27%, efusão
pelural, ascite, efusão retroperitoneal, efusão perirenal
|
Geralmente ocorre em conjunto com sinais de
hiperidratação do espaço intersticial (ver Tabelas 4 e 5)
Tabela 2
Estádios e sinais
clínicos
|
FC
|
TPC
|
mucosas
|
Pulso periférico
|
PAS
|
extremidades
|
Temperatura corporal
|
|
Compensatório
|
|
Gato
|
Raramente reconhecido (duração de segundos a
alguns minutos)
|
|
Cão
|
Normal ou >
|
1-2s
|
Normal ou vermelha
|
delimitado
|
Normal ou >
|
temperatura normal ao toque
|
Hipotermia, hipertermia ou normotemia
|
|
Descompensatório precoce
|
|
gato
|
Normal ou <
|
>2s
|
pálida
|
fraca
|
baixo
|
boa ao toque
|
hipotermia
|
|
Cão
|
aumentado
|
>2s
|
pálida a branca
|
fraca
|
Normal ou <
|
boa ao toque
|
Hipotermia, hipertermia ou normotermia
|
|
Descompensatório tarde
|
|
gato
|
diminuido
|
>2s or absent
|
brancas
|
ausente
|
baixo ou incapaz de obter
|
boa a fria ao toque
|
hipotermia
|
|
Cão
|
Normal ou <
|
>2s or absent
|
brancas
|
ausente
|
baixo ou incapaz de obter
|
boa a fria ao toque
|
Hipotermia, hipertermia ou normotermia
|
Tabela 3
Desidratação intersticial estimada (%) com base no
físico
Resultados do exame
|
Estimativa de desidratação %
|
Exame físico encontrado
|
|
<5%
|
Não detectado
|
|
5-6%
|
Alguma alteração no tugor de pele
|
|
6-8%
|
Diminuição leve do tugor da pele
Membrana mucosas secas (A xerostomia pode estar
presente em pacientes com IRA e DRC sem desidratação)
|
|
8-10%
|
Tugor cutâneo obviamente diminuído
Retração de globo ocular
|
|
10-12%
|
Perda completa da elasticidade da pele
Córneas opacas (Globos retraídos também podem
estar presentes)
Evidencia de hipovolemia
|
|
>12%
|
Choque hipovolêmico
Morte
|
Observação: há uma variação clínica substancial na
correlação entre os sinais clínicos e o grau de desidratação, portanto, esta é
apenas uma estimativa. Reimpresso de Silverstein DC e Hopper K, eds., Small
Animal Critical Care Medicine, 3ª ed., Rudloff, E, Avaliação da hidratação, p.
1054-58, Elsevier (2022), com permissão da Elsevier.
Tabela 4
Parâmetros de avaliação do estado de hidratação
extracelular e Alterações esperadas em relação à linha de base em pacientes que
recebem hipo ou hidratação excessiva
|
Parametros
|
Hipohidratação
|
superhidratação
|
|
Tugor cutâneo
|
<
|
>
|
|
<membrana mucosa
|
<
|
>
|
|
volume celular
|
>
|
<
|
|
Proteína total
|
>
|
<
|
|
Ureia e nitrogênio sanguineo
|
>
|
<
|
|
Osmolaridade urinária
|
>
|
<
|
|
Gravidade urinária especifica
|
>
|
<
|
Reimpresso de Silverstein DC e Hopper K, eds.,
Small Animal Critical Care Medicine, 3ª ed., Rudloff, E, Avaliação da
hidratação, p. 1054-58, Elsevier (2022), com permissão da Elsevier.
Tabela 5
Achados clínicos e diagnósticos adicionais que
podem indicar Hidratação excessiva/sobrecarga de fluidos
Ganho de peso agudo
Sinais respiratórios
·
Taquipnéia
·
tosse
·
sons pulmonares úmidos
·
respiração difícil
·
Achados diagnósticos por imagem consistentes com
derrame pleural, ascite, e/ou edema pulmonar
Edema
·
Quemose
·
Edema subcutâneo
·
Edema orgânico e disfunção (por exemplo sinais
gastrointestinal, alteração mental, arritmia)
Secreção serosa nasal
Efusão cavitária
Poliúria na ausência de insuficiência renal
Tremores
Inquietação
Tabela 6
Condições que representam desafios ao abordar
indivíduos
Necessidades do compartimento de fluidos
|
Condição
|
Desafio
|
|
Choque hipovolêmico em gatos
|
Gatos normalmente desenvolvem bradicardia, hipotermia e hipotensão
Este conjunto de eventos torna os gatos mais susceptíveis a
hipervolemia e superhidratação comparado com cães e estratégias similares de
ressuscitação com fluidos são usadas (veja tabela 2)
|
|
Aumento da permeabilidade capilar (por exemplo
devido ao sistema inflamatório, queimaduras, trauma)
|
Pode resultar
tanto em hipovolemia hipovolemia quanto em superhidratação
|
|
Falha congestiva aguda cardíaca no paciente
recebendo diurético e redutores pós carga
|
Pode
resultar em má perfusão e sinais de choque devido disfunção cardiovascular
|
|
Terapia diurética osmótica ou hiperglicemia
descontrolada
|
Pode levar
a hipervolemia e redução do volume de agua intracelular.
|
Seção 3:
Fluidos para reposição e manutenção
Três
principais conclusões
1. Calcule
as necessidades de fluidos com base nas três fases principais da terapia:
ressuscitação, reidratação e manutenção. A via de administração depende da
gravidade do déficit de fluidos do paciente e sua capacidade de ingerir
líquidos por via oral. Quando possível, rotas enterais devem ser utilizadas.
2. Use fluidos de reposição, também
chamados de cristaloides isotônicos (NacL0,9%,
Ringer com lactato por ex), para tratar hipovolemia e desidratação,
lembrando que cada condição requer estratégias diferentes. Pacientes
hipovolêmicos requerem reposição imediata de volume intravascular administrado
como um ou mais pequenos bolus de fluidos intraósseos (IO) ou IV durante 15–30
min. Pacientes desidratados requerem administração sustentada de fluidos
durante 12–24 h.
3. Use fluidos de manutenção, também
conhecidos como cristaloides hipotônicos
(0,45% NacL por exemplo), para fornecer necessidades diárias de fluidos em
pacientes com ingestão de fluidos inadequados. Usando
cristaloides isotônicos para atender às necessidades de fluidos de manutenção
pode levar a distúrbios eletrolíticos em pacientes.
Visão geral
Ao desenvolver um plano de terapia de reposição ou
manutenção de fluidos adapte o tipo de fluido, volume, via de administração e
taxa de administração a cada paciente. Tenha em mente que avaliar o estado de
um paciente o equilíbrio de fluidos não é um evento único. Como o estado
clínico do paciente progride, ajuste a prescrição de fluidos para atender às
necessidades contínuas, resposta à terapia e o curso da doença.
Hipovolemia e
desidratação são duas condições médicas relacionadas que envolvem uma
deficiência de fluidos no corpo e requerem terapia de reposição de fluidos.
Embora essas condições compartilhem laços semelhantes, há diferenças distintas
entre eles e administração de fluidos com estratégias diferentes.
Pacientes com déficit de volume intravascular, ou
hipovolemia requerem rápida reposição de fluidos intravenosos. Por outro lado,
pacientes com déficits de fluidos devido à ingestão inadequada de fluidos e
perdas contínuas, ou desidratação, necessita de reposição lenta e sustentada do
déficit de fluidos, permitindo os compartimentos intersticial e intracelular
para reabsorver estes fluidos. Uma vez que os pacientes estejam adequadamente
hidratados e euvolêmicos, eles podem necessitar apenas de terapia de manutenção
com fluidos se não forem capazes manter a homeostase dos fluidos por meio da
ingestão oral.
Gerenciando a
hipovolemia
Hipovolemia refere-se a uma diminuição do volume de
sangue circulante, o que resulta em redução da perfusão tecidual. Ocorre quando
ambos os fluidos e eletrólitos são perdidos, levando a uma diminuição do volume
sanguíneo total no sistema circulatório (Figura 3). A hipovolemia pode ser
causada por vários fatores, como sangramento excessivo, queimaduras graves,
diarreia ou vômitos graves, doença renal ou ingestão inadequada de líquidos. Os
parâmetros para detectar hipovolemia estão listados na Tabela 2.
Figura 3
A hipovolemia resulta em uma diminuição do volume
dentro do espaço vascular. A hipovolemia aguda afeta principalmente este
compartimento. Como a gravidade e a duração da hipovolemia persistem, podendo
afetar outros compartimentos também.
Atenção médica imediata é crucial para pacientes
hipovolêmicos porque a hipovolemia não tratada pode levar a complicações
sérias. O tratamento envolve a administração de fluidos intravenosos para
restaurar o volume sanguíneo e tratar a causa subjacente.
Corrigir a hipovolemia administrando um fluido
isotônico tamponado bolus de 5–10 mL/kg
(gatos) e 15–20 mL/kg (cães) durante 15–30 min. Os bolus podem ser repetidos
se as metas hemodinâmicas e de perfusão desejadas não forem alcançadas e o
paciente permanecer hipovolêmico (Figura 4).
Figura 4
O tratamento da hipovolemia requer a administração
rápida de fluidos no espaço vascular para restaurar o volume circulante
efetivo.
Gerenciando a
desidratação
A desidratação é uma condição na qual o corpo perde
mais fluidos do que ele absorve, resultando em um desequilíbrio de água e
eletrólitos (Figura 5). Ingestão inadequada de líquidos, respiração ofegante
excessiva em cães, vômitos, diarreia ou condições médicas como diabetes podem
causar desidratação. Os parâmetros para detectar desidratação estão listados na
Tabela 3.
Figura 5
A desidratação resulta em uma diminuição de volume
no espaço intersticial.
Dependendo do grau de desidratação, geralmente pode
ser controlado pela reposição de fluidos perdidos por meio de reidratação oral
ou administração de fluidos subcutâneos (SC). A administração de fluidos IV é
preferida em casos graves de desidratação ou em pacientes que não toleram
administração oral.
A desidratação pode ser corrigida calculando o
déficit de fluidos (Caixa 3) com base no grau de desidratação (Tabela 3) e na
administração de terapia de fluidos ao longo de 12–24 horas (Figura 6).
Caixa 3:
Cálculando o déficit de fluidos
Deficit de
fluidos (mL ) = Peso corporal X % desidratação
Pode
se também utilizar essa Fórmula abaixo de fluidoterapia de reposição de volume
para o paciente desidratado e fluidoterapia de manutenção
|
Passos
|
Fórmulas
|
|
Fluidoterapia de reposição de volume
|
|
1
|
Déficit
de volume (desidratação) para 24 horas
|
|
Volume
de reposição (mL) = [peso corpóreo (Kg)] x [Porcentagem de desidratação] x
1000
|
|
2
|
Perda
insensível de 20 mL/kg/dia
|
|
Volume
de reposição (mL) = [peso corpóreo (Kg)] x [perda estimado mL/kg]
|
|
3
|
Volume
total a ser administrado em 24 horas
|
|
Passo
1 + Passo 2 = volume total em mL, realizar proporção do tempo de 4 a 6 horas.
|
|
Fluidoterapia de manutenção
|
|
4
|
Perdas
mensuráveis ocorridas no período de reposição de volume
|
|
Produção
de urina (mL) + vômito (mL) + diarreia (mL) = x mL
|
|
5
|
Perda
insensível de 20 mL/kg/dia, realizar proporção para o período estimado de 4 a
6 horas.
|
|
Volume
de reposição (mL) = [peso corpóreo (Kg)] x [perda estimado mL/kg]
|
|
6
|
Passo
4 + Passo 5 = volume total em mL
|
Nos
casos de LRA secundária a sepse ou nos estados inflamatórios graves
(pancreatite), o uso de norepinefrina
como vasopressor deve ser a primeira intervenção quando os pacientes permanecem
hipotensos (pressão arterial média <60mmHg), mesmo após ressuscitação
volêmica. Além da norepinefrina, o uso de vasopressina
como vasopressor adjuvante está indicado na hipotensão refratária, ou nos casos
em que a acidemia severa pode afetar a função dos receptores adrenérgicos. Se
mesmo diante da infusão de vasopressores não ocorrer aumento da pressão
arterial, deve-se considerar possibilidade da existência de
hipoadrenocorticismo relativo.
Para
as ocasiões onde não é possível mensurar o débito urinário, modifica-se a base
do cálculo. O volume de fluidoterapia de manutenção passa a ser de 44 a 66
mL/kg/dia, desde que a produção de urina pareça normal ou aumentada, com a
adição das perdas mensuráveis oriundas do vômito e diarreia. Para pacientes
poliúricos maiores taxas como 50 a 60 mL/kg/dia, em casos de oligúria leve essa
taxa deve ser reduzida 20 a 25 mL/kg/dia, ou até mesmo interrompida em
pacientes anúricos. Para um cálculo rápido de volume de fluido na
manutenção: Animais novos gatos=80 x peso0,75 ou 2-3
mL/kg/h; cães 132xpeso0,75 ou 2-6mL/kg/h. Animais velhos: gato 10 a
20 mL/kg/dia, cães PP 13 a 20 mL/kg/dia, M a G 10 a 20 mL/kg/dia.
Figura 6
O tratamento da desidratação requer a administração
lenta e sustentada de fluidos intravasculares, que serão absorvidos lentamente
no espaço intersticial mais de 12-24 horas. As vias subcutânea e oral não são
descritas; no entanto, essas rotas também corrigem a desidratação.
Gerenciando a
hipovolemia e a desidratação
Nos casos em que tanto a hipovolemia quanto a
desidratação estão presentes (Figura 7), trate primeiro a hipovolemia e depois a
reidratação (Figura 8). Ambas as prescrições de fluidos devem incluir desfechos
concretos para monitorar e identificar quando a hipovolemia e a desidratação
foram resolvidas (Tabela 7). Além disso, a avaliação ultrassonográfica das
câmaras cardíacas e da veia cava caudal (indicie de colapsividade da veia cava
caudal) pode ser usado como uma avaliação válida da responsividade a fluidos.
Figura 7
A desidratação resulta numa diminuição do volume
dentro do espaço intersticial. À medida que a desidratação piora, ela pode
afetar os compartimentos vasculares e intracelulares também, levando à
desidratação com hipovolemia concomitante.
Figura 8
O tratamento da desidratação grave e da hipovolemia
requer uma dupla estratégia. Primeiro, corrija a hipovolemia administrando
rapidamente a infusão intravascular e restaure o volume circulante efetivo. Uma
vez que a hipovolemia tenha sido resolvida, trate a desidratação com o
administração lenta e sustentado de fluidos intravasculares ao longo de 12 a 24
horas.
Tabela 7
Pontos finais para monitorar hipovolemia e desidratação
|
Fluido
|
Hipovolemia
|
Desidratação
|
|
Estratégia de
tratamento inicial
|
• 5-10 mL/kg (gato), 15-20 mL/kg (cão) de um fluido
isotônico por 15 minutos
• Avalie os parâmetros de perfusão no final de cada
bolus
|
• Calcule o volume de reposição e entregue em 12 a
24 horas.
• Avaliar os parâmetros do paciente em todo o
período de entrega do fluido com o objetivo de corrigir o déficit total de
desidratação dentro de 12 – 24 horas
|
|
Pontos Finais
|
• Melhoria na frequência cardíaca, TPC, PAS e
estado mental
|
• Melhoria do turgor da pele, das mucosas e
gravidade específica da urina e aumento do peso corporal e da produção de
urina
|
|
Estratégia de
tratamento final
|
• Se os sinais vitais retornaram ao normal, avalie
se a desidratação precisa ser tratada e continue com um plano de fluidos de
reidratação. • Se os sinais vitais melhoraram, mas não normalizaram, repita o
mesmo bolus ou um volume menor e reavalie.
|
• Se os pontos finais retornaram ao normal, então
avaliar se a ingestão oral é possível. Se não, continue com o plano de
fluidos de manutenção. • Se a desidratação não tiver sido completamente
resolvida ecalcular as necessidades de fluidos e administrar durante mais 12
a 24 horas.
|
Seleção de
fluidos para administração intravenosa
Para prescrever a terapia de fluidos intravenosos
adequada, muitos fatores devem ser considerados, incluindo a idade do paciente,
condições médicas atuais e subjacentes (por exemplo, insuficiência renal ou
cardíaca, hipoproteinemia), equilíbrio de fluidos e eletrólitos e outras
necessidades específicas (ver Seção 5, Fluidoterapia em Pacientes Doentes).
Esses fatores influenciam a escolha de Tipo de fluido IV e se são necessários
ajustes na composição do fluido ou na taxa de administração.
Cristaloides
As soluções cristaloides são o tipo mais comum de
fluido utilizado e estas podem ser classificadas como soluções de substituição
ou manutenção a composição das soluções de substituição assemelha-se à do
fluido extracelular (Tabela 8). As soluções de manutenção contêm menos sódio e
mais potássio do que os fluidos de reposição (Tabela 8).
Tabela 8
Composição de cristaloides comumente usados
Rudloff E, Hopper K. 2021.
Composições cristaloides e coloides e seu impacto. Frontiers in Veterinary
Science. 8:639848.
Strandvik GF. 2009. Solução
salina hipertônica em cuidados intensivos: uma revisão da literatura e
diretrizes para uso em estados hipotensivos e pressão intracraniana elevada.
Anestesia. 64(9):990-1003
Holden D, et al. 2023. Uso de solução
salina hipertônica em cuidados neurocríticos para tratar edema cerebral: uma
revisão da formulação, dosagem, segurança, administração e armazenamento
ideais. Composição de cristaloides comumente usados1,2–4 Revista Americana de
Farmácia do Sistema de Saúde. 80(6):331-342.
Carr CJ, et al. 2021. Uma
auditoria e comparação de pH, concentração medida e material particulado em
soluções salinas de manitol e hipertônicas. Frontiers in Neurology. 12:667842.
Manutenção
versus fluidos de reposição
Usando o termo “fluidos de manutenção” para se
referir a uma administração de fluidos é um equívoco comum. Em vez disso, o
termo se refere a uma classificação de soluções cristaloides formuladas com
diferentes concentrações de eletrólitos para atender às necessidades diárias do
paciente. Substituição fluidos (por exemplo, solução de Ringer com lactato)
destinam-se a repor a água corporal perdida fluidos e eletrólitos (Tabela 8).
Os fluidos de reposição são frequentemente usados
de forma intercambiável para atender às necessidades de substituição e
manutenção — onde os clínicos suplementam fluidos de reposição com potássio ou
dextrose para aproximar os requisitos de manutenção. Usando reposição fluida de
longo prazo em vez de fluidos de manutenção podem predispor os pacientes
distúrbios de sódio e hipocalemia. Embora não haja evidências de que o uso de
fluidos de reposição como fluidos de manutenção tenha efeitos prejudiciais a
curto prazo, é importante referir-se a esses fluidos corretamente e garantir
que as necessidades de manutenção do paciente (composição eletrolítica e volume
administrado) sejam devidamente atendidos.
Concentração
de sódio
Considere sempre a concentração de sódio do paciente.
Os cães têm uma menor concentração média de sódio (145 mEq/L) em comparação com
a dos gatos (155 mEq/L), e pacientes pediátricos podem ter uma concentrações de
sódio mais baixas do que em adultos. Embora o sangue no local de atendimento a
análise facilita a obtenção de resultados rápidos, mas pode não estar sempre
disponível em casos em que é necessária ressuscitação hídrica imediata. Em
situações em que a concentração de sódio é desconhecida, a melhor escolha de
fluido é um fluido isotônico tamponado. Uma vez obtida a concentração de sódio
ajustar a escolha do fluido para refletir melhor as necessidades do paciente
(Tabela 8).
Calculando as
necessidades de fluidos
Divida o plano de fluidoterapia em ressuscitação,
reidratação e taxas de manutenção (Tabela 9) da seguinte forma:
Necessidade
total de fluidos = taxa de ressuscitação
+ taxa de
reidratação (inclui perdas contínuas)
+ taxa de
manutenção
Tabela 9
Dosagem de Fluidoterapia de acordo com o estágio de
necessidade de fluidos
|
Estádio
|
Fórmula
|
Tempo de
administração
|
Comentários
|
|
Ressuscitação
|
Gato: 5 – 10 mL/kg
Cães: 15 – 20
mL/kg
|
15 minutos
|
Avalia parâmetros
de perfusão após bolus. Pode repetir bolus conforme necessário.
|
|
Reidratação
|
Total déficit de
fluido (mL) = Peso x % desidratação
|
Sobre 12-24 horas
|
As perdas
contínuas devem ser avaliadas por meio de resultados e incorporadas ao plano
de fluidos
|
|
Manutenção
|
Cão
a. 60 mL/kg/dia
b. 132 x peso 0,75
c. 30 x peso + 70
mL/kg/dia
gato
a. 40 mL/kg/dia
b. 80 x peso 0,75
c. 30 x peso + 70
mL/kg/dia
Pediátrico
Cão: 3 x dose
adulta
Gato: 2,5 x dose
adulta
|
Sobre 24 horas
|
Incorpore também
água enteral, dieta líquida e medicamentos intravenosos ao volume total do
plano de fluidos.
|
Existem várias fórmulas disponíveis para calcular as
necessidades de fluidos, e não há evidências de que um seja superior ao
outro. Independentemente de a fórmula
utilizada, personalizar o plano de fluidos para cada paciente e ajustar om base
em descobertas de monitoramento de pacientes e perdas contínuas.
Seleção de
rotas de administração de fluidos
A escolha da via de administração de fluidos depende
da gravidade do déficit de fluidos e a capacidade do paciente de ingerir
fluidos por via oral ou por meio de uma sonda de alimentação. A hipovolemia
sempre requer administração de fluidos IV ou IO. No entanto, a desidratação
pode ser corrigida por via intravenosa, subcutânea ou enteral ou uma combinação
dessas vias.
Selecionando
rotas IV e IO
As vias de administração IV e IO são preferidas em
pacientes com déficits graves de fluidos, perdas agudas de fluidos e déficits
de perfusão, bem como em pacientes com ingestão mínima ou nenhuma de fluidos
orais ou enterais. Estas rotas permitem a rápida dispersão de fluidos e
eletrólitos, garantindo dosagem precisa e administração segura de grandes
volumes de fluidos e hiper fluidos tônicos.
A via IO é normalmente usada em pacientes para os
quais o acesso IV não é possível e serve como uma ponte para ressuscitação até
que um cateter IV possa ser colocado. No entanto, as taxas de infusão IO são
mais limitadas do que as intravenosas, por exemplo, os locais do úmero e do fêmur
(IO) permitem taxas de infusão de cateter de até 1 mL/kg/min.
Selecionando a
rota SC
A via SC é preferida para terapia de fluidos
ambulatorial ou para pacientes recebendo fluidos por várias vias (por exemplo,
fluidos intravenosos durante a hospitalização diurna e fluidos subcutâneos
durante a noite). No entanto, faltam evidências sobre a seleção ideal para
fluido SC, o volume ideal de infusão SC e a frequência de tratamento, e os
possíveis efeitos adversos dos fluidos SC. A Tabela 10 fornece recomendações
empíricas para terapia de fluidos SC.
Tabela 10
Recomendações empíricas de terapia de fluidos
subcutâneos
|
Dose
|
Freq.
|
Tipo de fluido
|
Comentários
|
|
20-30 mL/kg
|
1x ou 2x ao dia
|
• Lactato de Ringer, Plasma-Lyte ou Normosol R
• 0,9% NaCl tem pH baixo e pode ser doloroso.
Evite o uso de SC
|
• Aplique em vários locais dependendo do volume e
da elasticidade da pele. A quantidade máxima é de 10–20 mL/kg por local.
|
Para estimar a porcentagem de desidratação do
paciente e calcular as necessidades de fluidos de manutenção, siga as
recomendações descritas acima. É importante evitar prescrever fluidos SC para
pacientes euhidratados porque não há evidências de que tal terapia seja
benéfica, e pode ser prejudicial em pacientes com problemas de homeostase dos
fluidos corporais (por exemplo, doença cardíaca subjacente e hipoproteinemia).
Use um novo conjunto de administração de fluidos e uma bolsa de fluidos para
cada indivíduo.
Selecionando
Administração Enteral
Sempre que possível, utilize a via de administração
enteral. Os fluidos são frequentemente subutilizados e devem ser parte
integrante do plano de terapia se os pacientes tolerarem líquidos orais.
Colocação de tubos de alimentação podem auxiliar no fornecimento de fluidos
entéricos em pacientes anoréxicos e deve ser considerado como parte de um plano
geral de fluidoterapia.
Fluidos entéricos podem ser usados exclusivamente
para corrigir desidratação leve em pacientes com ingestão inadequada de
líquidos ou para suplementar a administração parenteral. Primeiro, estime a
porcentagem de desidratação do paciente e então calcular as necessidades de
fluido de manutenção como de costume. Dietas líquidas e água oral podem ser
administradas por ingestão voluntária ou sondas de alimentação (por exemplo,
nasogástrica e esofagostomia). A administração enteral pode ser particularmente
útil em pacientes desidratados que não podem tolerar fluidos IV (ou seja,
pacientes com doença cardíaca ou hipoproteinemia). Se houver uma sonda de
alimentação, administre fluidos entéricos com bolus intermitente ou como uma
infusão contínua com uma bomba de fluido. Tome cuidado para rotular os fluidos
orais adequadamente para evitar erros de conexão que possam levar à
administração acidental de água ou de uma dieta líquida em um espaço vascular
do paciente.
Seção 4:
Fluidoterapia e Anestesia
Três
principais conclusões
1. A
maioria dos animais saudáveis submetidos a cirurgia eletiva não necessita
fluidos no período pós-operatório. Em vez disso, o retorno precoce à
alimentação e beber é recomendado.
2. Pacientes
que não estavam comendo antes da anestesia podem precisar de terapia de fluidos
pós-operatória até que possam consumir voluntariamente o suficiente para
atender às suas necessidades. Para pacientes que não devem comer bem após a
cirurgia, como em gatos geriátricos, os fluidos SC podem ser considerados para
usar em casa.
3. Em
pacientes com doença renal (especificamente, aqueles em tratamento (Estádio 3
ou 4 da IRIS), não tente corrigir a hipotensão usando taxas excessivas de
infusão de fluidos.
Visão geral
A fluidoterapia é recomendada em pacientes submetidos
à anestesia geral, principalmente para neutralizar a vasodilatação e a
diminuição da frequência cardíaca induzida por anestésicos inalatórios, bem
como para manter a permeabilidade do cateter. Antes da publicação das
Diretrizes de Fluidoterapia AAHA/AAFP de 2013 para Cães e Gatos, a taxa de
administração de fluidos recomendada durante a anestesia era de 10 mL/kg/h, sem
uma base de evidências. No entanto, taxas de fluidos excessivamente altas
predispõem os pacientes anestesiados a um risco aumentado de sobrecarga de
volume e suas consequências associadas. As diretrizes de 2013 recomendaram
redução das taxas de fluidos em pacientes anestesiados para 5 mL/kg/h em cães e
3 mL/kg/h em gatos. Embora estes tenham reduzido as taxas de administração, não
foram submetidas a um estudo formal, elas foram amplamente aceito e
implementado na prática clínica.
Objetivos da
Fluidoterapia em Pacientes Anestesiados
A seção a seguir aborda aspectos importantes da
administração de fluidos antes, durante e depois da anestesia, incluindo
mecanismos para tratar a hipotensão e evitar a sobrecarga de fluidos. (Para
obter mais informações sobre o paciente anestesiado, consulte o AAHA Anestesia
e Diretrizes de monitoramento para cães e gatos, disponíveis em aaha.org.).
1. Considere
potenciais déficits de fluidos (por exemplo, perdas por desidratação, jejum,
perdas insensíveis ou perdas de fluidos previstas durante a cirurgia). Sempre
que possível, tente corrigir 80% do déficit de desidratação do paciente nas 24
horas anteriores à anestesia.
2. Para
a maioria dos pacientes, não é necessário reter água antes da anestesia.
3. Coloque
cateteres intravenosos em todos os pacientes submetidos à anestesia.
4. Administrar
fluidos cristaloides isotônicos balanceados usando os seguintes diretrizes:
a. Taxa
inicial de fluidos de 5 mL/kg/h em cães com função cardíaca e renal;
b. Taxa
inicial de fluidos de 3–5 mL/kg/h em gatos com função cardíaca e renal normal.
5. Os
fluidos intravenosos podem ser benéficos para manter a permeabilidade do
cateter e apoiando a função cardiovascular. No entanto, pacientes euhidratados
e euvolêmicos que recebem anestésicos injetáveis por curtos períodos geralmente
não necessitam de fluidos intravenosos. Alimentos e água devem ser oferecidos
conforme necessário o mais rápido possível após a recuperação, mas fluidos SC
podem ser administrados para pacientes que não retornam a comer e beber
imediatamente. Priorizar a correção da hipovolemia e da desidratação antes da
anestesia geral sempre que possível.
6. Para
garantir a perfusão adequada do tecido, mantenha uma pressão arterial média
mínima de 60 mm Hg.
Gerenciando a
Hipotensão
A hipotensão é uma complicação comum da anestesia
geral envolvendo anestésicos inalatórios (Figura 9). Tanto a hipovolemia
absoluta (por exemplo, devido a hemorragia) e hipovolemia relativa (por
exemplo, decorrente de trauma, sepse ou uso de anestésicos e drogas
vasodilatadoras) também pode contribuir para a hipotensão. Em casos de
hipotensão durante anestesia, comece ajustando as configurações excessivas do
vaporizador e administrando criteriosamente os fluidos cristaloides.
1. Avalie
cuidadosamente a profundidade anestésica de cada paciente. Pequenas reduções em
a administração de anestésicos inalatórios (ou seja, configurações do
vaporizador) pode afetar substancialmente a pressão arterial e fazer a
diferença entre normotensão e hipotensão.
2. Monitore
a frequência cardíaca do paciente. A bradicardia pode contribuir para a
hipotensão em pacientes anestesiados. Se a frequência cardíaca estiver menor
que o normal e o paciente estiver hipotenso, considere terapia anticolinérgica.
3. Avalie
a temperatura corporal. A diminuição da temperatura corporal ou a hipotermia
podem causar hipotensão. Abra as cavidades corporais e a respiração em gases
frios da máquina de anestesia pode levar a uma diminuição da temperatura
corporal. O aumento da temperatura corporal irá ajudar a melhorar a hipotensão.
4. Considere
a administração concomitante de analgésicos adicionais, sedativos, ou uma
combinação de ambos para ajudar a reduzir as necessidades de anestésicos
inalatórios, bem como o uso de anestesia regional ou local.
5. Administrar
fluidos cristaloides isotônicos balanceados ao usar inalantes anestésicos: i.5
mL/kg/h para cães, ii.3–5 mL/kg/h para gatos.
6. Se
a hipotensão persistir apesar do ajuste das configurações do vaporizador e do
fornecimento de fluidos cristaloides, considere terapia medicamentosa simpatomimética com inotrópicos ou vasopressores
ou terapia com fluidos coloides.
7. Se
a hipotensão for devida a hemorragia grave ou contínua, será necessária a
transfusão de sangue total ou de concentrado de hemácias para manter o volume
sanguíneo e a massa de glóbulos vermelhos adequados para fornecer oxigênio aos
tecidos.
8. Tenha
em mente que nem todos os casos de hipotensão podem ser corrigidos com
administração de fluidos, particularmente em pacientes pediátricos e aqueles
com doença cardíaca, sepse, etc. (ver Seção 5, Distúrbios Cardiorenal,
Fluidoterapia em Pacientes Doentes).
9. Lembre-se
de que tanto a hipovolemia quanto a hipervolemia são prejudiciais aos pacientes
anestesiados.
Figura 9
Terapia de Fluidos Durante a Anestesia
O
paciente está adequadamente hidratado apesar do jejum?
|
Sim
Iniciar
terapia com fluidos cristaloides em 3–5 mL/kg/h
|
Não
Estimar
a porcentagem de desidratação e corrigir o déficit de volume antes da
anestesia
|
Se o
paciente ficar hipotenso (pressão arterial média <60mmHg) durante o
procedimento:
- Avalie a
profundidade da anestesia e reduza a configuração do vaporizador, se possível.
- Avalie a
temperatura corporal e forneça aquecimento ativo conforme necessário.
- Administre
analgésicos, sedativos e anestésicos locais adicionais, se possível, para
ajudar a reduzir a presa do vaporizador.
Se a
hipotensão persistir:
Administrar um
bolus de fluido cristaloide: 5 mL/kg ao longo de 10 minutos.
Se a
hipotensão for refratária à administração de fluidos cristaloides:
1.
Administrar
terapia simpaticomimética se necessário:
• Efedrina 0,05–0,2 mg/kg IV em bolus
• Norepinefrina infusão continua 0,05–1
µg/kg/min
• Dobutamina infusão continua 1–10 µg/kg/min
• Epinefrina infusão continua 0,05–1
µg/kg/min
2.
Administrar
um bolus coloidal: 2–5 mL/kg durante 10 minutos.
3.
Em
pacientes com hemorragia grave ou contínua, abordar com produtos sanguíneos apropriados,
como sangue total sangue ou concentrado de hemácias.
Se a
hipotensão for resolvida:
Retorne à
terapia inicial de 3–5 mL/kg/h de fluidos cristaloides, a menos que haja
suspeita de sobrecarga de fluidos
Monitoramento
1. Monitorar
a duração da anestesia e o volume total de administração de fluidos
cuidadosamente. Se as taxas de fluidos ultrapassarem 20 mL/kg em um único
episódio anestésico, reavaliar as taxas de administração de fluidos e o estado
do volume intravascular do paciente. Normalmente, a maioria animais saudáveis
não necessitariam de uma taxa de manutenção de 5 mL/kg/h por períodos
prolongados, a menos que ocorra perda significativa de sangue. Para determinar
a administração total de fluidos durante uma único evento anestésico, calcular
o volume da taxa de manutenção diária (Tabela 9).
2. Monitore
cuidadosamente os pacientes anestesiados para detectar quaisquer indícios de
administração excessiva de fluidos. Os sinais de sobrecarga de fluidos incluem
(ver Tabela 5 para sinais clínicos e diagnósticos adicionais):
a. Som
de galope ou sopro novo (especialmente em gatos)
b. Tecidos
edematosos e quemose
c. Inchaço
das patas
d. Secreção
nasal clara (edema nasal)
e. Crepitações
pulmonares
f.
Baixa saturação de oxigênio (SpO2)
g. Nenhuma
alteração na pressão arterial juntamente com outros sinais clínicos (ou seja,
os pacientes permanecem não hipertensos)
h. Derrame
pleural, ascite
3. Interrompa
a administração de fluidos (ou use um volume mínimo para manter permeabilidade
do cateter) se os pacientes apresentarem sinais de administração excessiva de
fluidos. Furosemida (1–2 mg/kg IV) pode ser necessária se os pacientes
apresentarem sinais de edema pulmonar (ou seja, crepitações pulmonares
audíveis, evidências de imagem de edema pulmonar ou SpO2 baixo) ou efusão
pleural.
4. Para
pacientes anestesiados submetidos a anestesia com ventilação mecânica de
pressão positiva, considere o uso de um monitor de variabilidade da pressão de
pulso ou índice de oximetria
variabilidade pletismográfica de pulso avançado para avaliar a responsividade a
fluidos. O monitor é usado em uma forma semelhante a um oxímetro de pulso e
ajuda a avaliar se o débito cardíaco aumenta com a expansão do volume.
5. Retorne
os pacientes cirúrgicos de rotina à alimentação e à bebida normais, o mais
rápido possível após a anestesia.
Pacientes com Doença Renal
Para
cuidar eficazmente de pacientes com doença renal (especificamente, aqueles no
estádio 3 ou 4 da IRIS) é crucial corrigir a desidratação antes da anestesia,
otimizar o débito cardíaco usando um protocolo anestésico apropriado que
suporte a função cardiovascular (evite dexmedetomidina se outras alternativas
estiverem disponíveis), monitore de perto e controle a pressão arterial. Tentar
retificar a hipotensão usando taxas excessivas de infusão de fluidos deve ser
evitado.
O uso de coloides sintéticos em pacientes é atualmente controverso devido
a considerações de segurança e eficácia e à falta de consenso baseado em
evidências. Para mais informações sobre coloides, consulte a Seção 7, Perguntas
e Controvérsias em Fluidoterapia.
Caixa 4: Necessidades especiais de terapia
de fluidos durante Pacientes com Doença Renal Anestesia
1.
Hipoglicemia
Adicione dextrose para raças de cães
pediátricos OU em resposta à hipoglicemia em cães ou gatos. • Adicione 50 mL de
dextrose a 50% a um saco de fluido de 1 L para criar uma solução de dextrose a
2,5%.
2.
Perda
aguda de sangue cirúrgico
Aumente a taxa de fluidos (até 10 mL/kg/h)
durante a correção cirúrgica do problema (por exemplo, perda de pedículo).
Considere que é necessário três vezes mais
volume de fluido cristaloide para repor um volume de sangue perdido. Se os
hemoderivados não estiverem disponíveis e a perfusão do paciente estiver
comprometida, considere um coloide para auxiliar a perfusão.
3. Hipoproteinemia
Use albumina
canina quando a proteína total for 2,0 g/dL (uma dose de 450 mg/kg de
albumina canina aumentará a albumina sérica em 0,5 g/dL). Comece com uma taxa
de 0,5 a 1 mL/kg por 30 min e aumente a taxa se não houver efeitos adversos.
Entregue ao longo de 3–4 horas. Para mais informações veja Mazzaferro EM, Edwards T. Atualização sobre terapia com albumina em
doenças críticas. Vet Clin North Am Small Anim Pract 2020;50(6):1289–305.
Use um colóide com um cristalóide quando a proteína
total for ,4,0 g/dL (hetamido 1–5 mL/kg/h no paciente anestesiado).
Use plasma fresco congelado ou congelado quando
disponível.
Considere que são necessários 20–25 mL/kg para
aumentar a albumina em 0,5 g/dL e, para cães de raças grandes, isso pode ser
proibitivo em termos de custo. Para doses específicas, consulte Beer KS,
Silverstein DC. Controvérsias no uso de plasma fresco congelado em pacientes de
pequenos animais gravemente doentes. J Vet Emerg Crit Care (San Antonio)
2015;25(1):101–6.
Seção 5:
Fluidoterapia em pacientes doentes
Três
principais conclusões
1. Não
se esqueça das vias entéricas de administração de fluidos, incluindo
nasogástrica, nasoesofágica ou esofágica, ao tratar pacientes doentes a gaua
pode ser misturada aos alimentos ou ser administrada separadamente.
2. Não
retenha fluidos em pacientes desidratados ou hipovolêmicos devido à anemia
concomitante. Monitore-os de perto para determinar se uma transfusão também é
indicada.
3. Mitigue
cuidadosamente os distúrbios eletrolíticos. Nunca administre um bolus de
fluidos suplementados com cloreto de potássio (KCl). Misture bem os fluidos
para garantir uma dispersão uniforme do KCl antes da administração. Gerencie
intencionalmente os distúrbios de sódio para evitar potenciais mudanças de
fluidos fatais no cérebro que podem ocorrer com a resolução rápida de
alterações crônicas (0,24–48 h) de sódio.
Visão geral
A terapia de fluidos em pacientes doentes requer uma abordagem cautelosa e equilibrada e a
capacidade de prever problemas antes que eles ocorram. A equipe veterinária
enfrenta desafios complexos na terapia de fluidos ao tratar pacientes que
apresentam condições como doença gastrointestinal, renal ou cardíaca, anemia,
desequilíbrios eletrolíticos, lesão cerebral traumática (TBI), choque
hipovolêmico ou vasodilatador, edema, distúrbios de termorregulação e
hipoglicemia.
Terapia
nutricional como um estímulo para terapia de fluidos enterais
A nutrição é
uma das necessidades mais negligenciadas do paciente durante a hospitalização.
Após 72 horas de anorexia, o metabolismo do paciente muda para fontes alternativas
de energia, como cetonas e ácidos graxos, em vez de glicogênio e glicose.
Sondas de alimentação nasoesofágica, nasogástrica ou esofágica facilitam a
ingestão calórica, e a água pode ser
misturada aos alimentos ou administrada separadamente. Use uma dieta enlatada
para aumentar a ingestão de água.
A capacidade
do estômago é de 5–10 mL/kg no momento do início nutrição enteral, e não há
consenso sobre os tempos de esvaziamento gástrico em cães e gatos (embora
tempos de esvaziamento prolongados tenham sido relatados). Use cálculos
conservadores das necessidades de fluidos e alimentos para nutrição enteral e
ajuste com base nos sinais clínicos de náusea, regurgitação e vômito do
paciente.
Determine as
necessidades de água enteral com base nas taxas de manutenção diária e divida
essa quantidade entre suplementação IV e enteral. É importante continuar a
fornecer livre acesso à água. Dado que as taxas de nutrição enteral normalmente
começam em um terço da necessidade de energia em repouso para evitar a síndrome
de realimentação, a administração de água enteral também pode ajudar a permitir
que a capacidade do estômago acomode volumes aumentados de alimentação de
nutrição enteral subsequente.
A ingestão de água de felinos varia em
torno de 45 mL/kg/dia e de caninos de 40 a 80 mL/kg/dia.
Anemia
Não retenha fluidos em pacientes anêmicos. Se um
paciente anêmico também estiver desidratado ou hipovolêmico, forneça terapia de
fluidos, reconhecendo que pacientes com baixo hematócrito podem necessitar de
hemoderivados. Em pacientes saudáveis, a ressuscitação de fluidos não
demonstrou diminuir as concentrações de hemoglobina. A terapia de fluidos pode
resultar em um aumento benéfico no fluxo microvascular e na perfusão com um
aumento geral no fornecimento de oxigênio em pacientes com choque hipovolêmico
ou distributivo. No entanto, a administração de fluidos em pacientes não
respondedores a fluidos ou com sobrecarga de fluidos pode levar a uma redução
relativa, mas não absoluta, na concentração de hemoglobina (“anemia
dilucional”), o que pode causar uma diminuição paradoxal no fornecimento de
oxigênio.
Monitore cuidadosamente pacientes anêmicos e
avalie-os minuciosamente quanto a choque, hipovolemia, desidratação e
necessidade de fluidos de manutenção. Essas necessidades devem ser abordadas
por meio de uma prescrição de fluidos apropriada. Esses pacientes podem se
tornar dependentes de transfusão quando ressuscitados ou reidratados
adequadamente. Os gatilhos da transfusão (por exemplo, frequência cardíaca, cor
da membrana mucosa, tempo de enchimento capilar, frequência e esforço
respiratório, qualidade do pulso, pressão arterial, mentalidade e atitude)
devem ser considerados em conjunto com os resultados dos testes laboratoriais
(por exemplo, contagem e tendências de hemácias concentradas, hematócrito,
níveis de hemoglobina e lactato sanguíneo) para determinar a necessidade de uma
transfusão de sangue.
Azotemia
Pacientes azotêmicos têm necessidades variáveis de
fluidos que dependem de fatores como seu estado de hidratação (incluindo
desidratação e sobrecarga de fluidos), níveis de produção de urina, início
agudo versus crônico, estado ácido-básico e eletrolítico, a causa subjacente da
azotemia e a extensão de sua gravidade. Esses pacientes apresentam desafios
especiais de monitoramento, pois podem apresentar xerostomia (boca seca)
secundária à uremia, tensão prolongada da pele devido à elasticidade reduzida
da pele associada ao envelhecimento, urina retida concentrada e níveis
relativos de creatinina imprecisos devido à diminuição da massa muscular. Além
disso, pode haver uma falta de uma concentração basal de creatinina ou peso
corporal anterior para comparação. Técnicas anedóticas para avaliar a
desidratação incluem avaliar o tugor da pele sobre a caixa torácica, analisar
tendências de peso e concentrações de sódio, histórico de ingestão de fluidos e
alimentos e identificar sinais de sobrecarga de fluidos (consulte a Seção 6,
Sobrecarga de fluidos).
Nos casos em que os pacientes não estão hipotensos, a
prescrição de fluidos deve proporcionar uma correção gradual da desidratação,
enquanto pacientes com comprometimento renal significativo devem receber
fluidos em taxas mais lentas. A
fluidoterapia não é o pilar do tratamento de pacientes azotêmicos. Em vez
disso, é para dar suporte aos rins corrigindo anormalidades tratáveis
associadas ao comprometimento renal para que os rins possam se curar. Os
principais aspectos envolvem a redução da carga de sódio e cloreto, o controle
da pressão arterial, o tratamento da anemia e infecções, a garantia de nutrição
adequada em curto prazo (sem restrição de proteína) e o tratamento da doença
primária que podem desencadear IRA secundária (por exemplo, pancreatite aguda)
ou apresentações de doença renal aguda sobre crônica. As necessidades de
fluidos para pacientes com doença renal crônica variam dependendo da gravidade
da poliúria e polidipsia, juntamente com outros sinais clínicos.
Doença
cardíaca
A consideração mais importante para a terapia de
fluidos em pacientes com doença cardíaca é prevenir o início da insuficiência
cardíaca. Para pacientes cardíacos, os objetivos terapêuticos incluem aumentar
a contratilidade miocárdica, diminuir a précarga e a pós-carga, neutralizar os
efeitos patológicos do sistema renina-angiotensina aldosterona, melhorar a
vasodilatação e otimizar o enchimento diastólico. Pacientes cardíacos podem
apresentar desidratação, hipovolemia relativa, distúrbios eletrolíticos,
azotemia moderada a grave e desequilíbrios metabólicos causados por
insuficiência cardíaca e medicamentos. A terapia de fluidos é frequentemente
evitada em pacientes cardíacos devido ao seu potencial de aumentar a pré-carga
na insuficiência cardíaca do lado esquerdo, aumentar a pós-carga e diminuir o
retorno venoso na insuficiência cardíaca do lado direito (especialmente na
presença de aumento da pressão intra-abdominal devido à ascite). Sempre que
possível, a ingestão de fluidos deve ser fornecida enteralmente, como por meio
de água e dieta enlatada. Quando for necessária a fluidoterapia, administrar
0,45% de NaCl com 2,5% de dextrose IV em taxas de manutenção de metade ou
diárias (consulte a Tabela 9 para taxas de manutenção), dependendo das
necessidades do paciente e da tolerância aos fluidos suplementares. A
hipotensão em pacientes com insuficiência cardíaca congestiva deve ser tratada
considerando inotrópicos positivos.
Distúrbios
Cardiorrenais
O eixo cardiorrenal é uma consideração importante
porque um estado patológico no sistema cardiovascular ou renal tem o potencial
de afetar o outro. O tratamento da doença renal se concentra em manter a
hidratação com água enteral, então há menos conflito com o tratamento da doença
cardíaca; no entanto, a administração de terapia de fluidos adicional apresenta
desafios. Medicamentos cardíacos podem potencialmente levar a azotemia leve por
meio de diurese (por exemplo, furosemida) e diminuição da taxa de filtração glomerular (TFG) (por exemplo,
enalapril e telmisartana). É crucial monitorar consistentemente a
sobrecarga de fluidos, azotemia progressiva grave, piora da insuficiência
cardíaca, alterações na pressão arterial e outros indicadores relevantes para
garantir que esses pacientes não decaiam como resultado da terapia de fluidos.
Mesmo com a melhor terapia possível, isso pode ser um desafio significativo.
Pacientes com
Hipovolemia e Edema
Alterações nas forças de Starling (pressão
hidrostática e oncótica) (Figura 2) pode contribuir para o desenvolvimento de
edema em pacientes veterinários. Causas comuns de edema incluem vasculite,
hipoalbuminemia, insuficiência cardíaca, insuficiência renal, obstrução
linfática e trombose. A fluidoterapia em pacientes hipovolêmicos e edematosos
apresenta um desafio terapêutico, e a causa subjacente do edema devem ser
levados em consideração para fornecer fluidos com segurança.
Quando o edema resulta de hipoalbuminemia, a
ressuscitação e a restauração do volume intravascular são primordiais, e os
colóides podem ser usado para aumentar a pressão oncótica coloidal. Isso pode
ser realizado com a administração rápida de colóides sintéticos (por exemplo,
hetas-tarch e tetrastarch [embora seu uso seja controverso; veja a Seção 7,
Perguntas e Controvérsias na Fluidoterapia]), albumina específica canina (CSA)
em cães, albumina sérica humana em cães ou gatos (que podem predispor os pacientes
a reações alérgicas ou anafilaxia) e produtos de plasma veterinário (por
exemplo, plasma fresco congelado, plasma congelado e plasma pobre em
crioprecipitado [CPP]).
Embora os produtos de plasma sejam menos propensos a
induzir reações alérgicas, grandes volumes de plasma são necessários para
alterar significativamente as concentrações de albumina (22 mL/kg de plasma para aumentar a albumina sérica em 0,5 g/dL), o
que resulta em maiores custos de cuidados e risco de sobrecarga de volume. Em
um estudo, não houve diferença nas concentrações médias de albumina sérica
antes e depois da transfusão com plasma fresco congelado (dose média de 15–18
mL/kg). Assim, embora um bolus de plasma possa ser usado para tratar
hipovolemia em pacientes edematosos, seu uso para essa finalidade é controverso
(Tabela 11). Determine a dosagem de KCl com base no soro do paciente Uma
infusão de taxa contínua (IRC) de CPP canino, administrada a uma taxa de
1,1–2,2 mL/kg/h, foi descrito em um relato de caso para tratar a hipoalbuminemia.
Esta pode ser uma opção mais razoável para tratar a hipoalbuminemia porque a
CPP tem um efeito maior concentração de albumina do que outros produtos
plasmáticos, embora o CPP está menos amplamente disponível.
O CSA parece ser uma alternativa relativamente segura
aos colóides sintéticos e aumenta as concentrações de albumina de forma mais
eficiente do que produtos de plasma. Em um estudo, a administração de CSA
melhorou o índice de choque em pacientes caninos hipovolêmicos. Em outro
estudo, CSA aumentou a pressão arterial dentro de 2 horas após a administração
em cães com peritonite séptica.
A administração de colóides a pacientes com edema
devido a vasculite pode ser controverso, pois os colóides podem vazar para o
espaço intersticial e piorar edema intersticial. Nestes pacientes, o uso
criterioso de colóides combinado com volumes menores de cristaloide. No geral,
independentemente da causa de edema, use cristaloides criteriosamente em todos
os pacientes afetados.
Diuréticos de baixa dosagem podem ser considerados em
pacientes com edema mas apenas em pacientes normotensos e normovolêmicos.
Lesão cerebral
traumática
O principal objetivo da terapia de fluidos no
tratamento de pacientes veterinários que têm O TCE está otimizando a pressão de
perfusão cerebral e a pressão arterial média. As diretrizes da Brain Trauma
Foundation para pacientes humanos recomendam manter a pressão arterial
sistólica entre 100e 110 mm Hg para reduzir a mortalidade e melhorar os
resultados.
Estudos que avaliam a escolha ideal de fluidos para
pacientes veterinários com TCE são limitadas. No entanto, as informações
baseadas em estudos clínicos em humanos e pesquisas com suínos e roedores
apoiam o uso de concentrado de hemácias, plasma e plaquetas sobre fluidos
cristaloides devido aos melhores resultados em pacientes com hemorragia
contínua.
Osmoterapia — usando agentes osmóticos (por exemplo,
solução salina hipertônica ou manitol) para reduzir o volume do conteúdo
intracraniano - é comum em tratamento de pacientes com TCE (Figura 10). Vários
estudos e uma meta-análises em medicina humana sugerem que tanto o manitol
quanto solução salina hipertônica reduz efetivamente a pressão intracraniana,
mas há nenhuma evidência para recomendar um em detrimento do outro. A solução
salina Hipertônica pode ter a vantagem de evitar a diurese, aumentar a
pré-carga cardíaca e impactar positivamente a perfusão cerebral. Em cães e
gatos, o manitol é geralmente
administrado em doses de 0,5–1 g/kg IV durante 15 min com um microfiltro,
enquanto a solução salina hipertônica (NaCl 7,2%) éadministrado em doses de 1–6
mL/kg IV durante 15 min. Infusão contínua de solução salina hipertônica foi
descrita em pacientes humanos, mas não afeta significamente o resultado.
Figura 10
Abordagem para terapia de fluidos para cães e gatos
com lesão cerebral traumática
Distúrbios
eletrolíticos
Desequilíbrios eletrolíticos são comuns em pacientes
doentes. A seleção adequada de fluidos e, se necessário, a suplementação de
eletrólitos auxiliam na restauração do equilíbrio.
Hipocalemia
Cães e gatos com problemas de saúde frequentemente
apresentam hipocalemia. Isso pode ser devido ao aumento da perda urinária ou
gastrointestinal, perda prolonga da anorexia, alcalemia, tumor secretor de
aldosterona ou tratamento com fluidos de reposição pobres em potássio. Os
sinais clínicos de hipocalemia podem incluir fraqueza, arritmias cardíacas e
problemas respiratórios e comprometimento muscular.
Tratar a hipocalemia com suplementação de KCl em
fluidos intravenosos (Tabela 11). Determine a dosagem de KCl com base na
concentração sanguínea do paciente. Para administração intravenosa de KCl,
calcule a mEq/kg/h a ser administrado, garantindo que a taxa de suplementação
não exceda 0,5mEq/kg/h, pois a administração rápida pode ser fatal. Nunca administre
em bolus fluidos suplementados com KCl. Antes da administração, inverta a bolsa
e misture bem os fluidos para garantir a dispersão uniforme do KCl. Tenha
cuidado com fluidos altamente suplementados ou CRIs de KCl para evitar bolus
inadvertido ou excesso ao paciente. Use configurações de bomba de fluido
apropriadas ou bombas de seringa como salvaguardas e educar a equipe sobre os
riscos de excesso da administração. Em casos de hipocalemia persistente mesmo
após administração de KCl, verifique os níveis de magnésio para determinar se é
necessária suplementação de magnésio.
Tabela 11
Diretrizes para suplementação de potássio em
fluidos
|
Concentração de K no soro
|
Sugestão de dose de potássio
|
Sugestão de adição de k em soro cristaloide para
60 mL/kg/dia para cães de 10 kg (25 mL/hora)
|
|
< 2.0 mEq/L
|
0,5 mEq/L/kg/hr
|
200 mEq/L
|
|
2.0 – 2,5 mEq/L
|
0,3 – 0,4 mEq/L/kg/hr
|
120 - 160 mEq/L
|
|
2.6 - 3 mEq/L
|
0,2 – 0,25 mEq/L/kg/hr
|
80 - 100 mEq/L
|
|
3,1 – 3,5 mEq/L
|
0,1 – 0,15 mEq/L/kg/hr
|
40 – 60
mEq/L
|
|
>3,5 mEq/L
|
0,05 mEq/L/kg/hr
|
20 mEq/L
|
Não
exceder 0,5 mEq/kg/hora (ClK a 10%=1,34mEq/mL; ClK a 15%=2,01 mEq/mL; ClK a
19,1%=2,56mEq/mL).
Desequilíbrios
de sódio
Distúrbios na concentração de sódio são comuns. Esses
casos devem ser gerenciado com cuidado deliberado para evitar mudanças de
fluidos potencialmente fatais no cérebro que podem ocorrer após correção
rápida, mais rápida que 0,5 mEq/ kg/h, de alterações crônicas (maiores que
24–48 h) de sódio.
Hiponatremia.
Pacientes com hiponatremia euvolêmica aguda (por
exemplo, polidipsia primária) podem apresentar sinais neurológicos e devem ser
tratados com 2–6 mL/kg de solução salina hipertônica de 3–7,5% ao longo de
10–15 min. Na hiponatremia crônica sintomática, uma abordagem semelhante usando
solução salina hipertônica deve ser tomada. Uma vez que os sinais clínicos
neurológicos se resolvam, o tratamento deve continuar de forma semelhante ao
dos pacientes com hiponatremia crônica assintomática. Em pacientes com
hiponatremia crônica assintomática, devem ser selecionados cristaloides
isotônicos (Tabela 12C) que tenham um conteúdo de sódio 10 mEq/L maior que o
sódio do paciente. Deve ser calculada uma taxa de correção que não exceda 0,5
mEq/L/h ou um aumento máximo de sódio de 10–12 mEq/L/dia para prevenir a
síndrome de desmielinização osmótica (Tabelas 12A, 12D). Pacientes com
hiponatremia hipovolêmica devem ser ressuscitados com um cristaloide que
contenha um conteúdo de sódio semelhante à concentração atual de sódio do
paciente. Dependendo da gravidade da hiponatremia, cristaloides isotônicos
comerciais podem não estar disponíveis com conteúdos de sódio semelhantes.
Nesses casos, fluidos personalizados podem ser adaptados.
Cloreto adicionando água estéril a um cristaloide
isotônico para atingir o teor de sódio desejado. Esses fluidos devem ser usados
exclusivamente para administração em bolus até que a hipovolemia seja
resolvida. Fluidos hipotônicos não devem ser usados em pacientes com
hiponatremia.
Hipernatremia.
As estratégias para tratar a hipernatremia são semelhantes às tomadas com
hiponatremia em relação às considerações de cronicidade e taxa de correção de
0,5 mEq/L/h. Quedas na concentração de sódio que são mais rápidas do que essa
taxa em pacientes com hipernatremia crônica podem causar mudanças abruptas de
fluidos que levam ao edema cerebral. No entanto, pacientes com hipernatremia
aguda podem passar por uma rápida correção da concentração de sódio sem o risco
de edema cerebral, usando fluidos IV hipotônicos. Calcule o déficit de água
livre e administre fluidos em uma taxa apropriada enquanto monitora as
concentrações de sódio frequentemente para permitir uma resolução segura da
hipernatremia (Tabela 13A).
Hipocloremia.
Mudanças relativas no cloreto geralmente ocorrem com
mudanças no sódio. Para avaliar distúrbios verdadeiros de cloreto em face do
sódio, o cloreto deve ser corrigido usando a seguinte equação:
Cl 5 corrigido=(Na normal/Na mensurado) x Cl
mensurado
Em pacientes com hipocloremia verdadeira que
desenvolveram alcalose metabólica, 0,9% de NaCl tem sido historicamente o
fluido de escolha devido à sua alta concentração de cloreto (154 mEq/L).
Recentemente, preocupações foram levantadas sobre o efeito de 0,9% de NaCl na
função renal devido ao risco potencial de causar hipercloremia, o que tem
demonstrado causar vasoconstrição renal e redução da pressão arterial renal.
Para usar com segurança NaCl a 0,9% em pacientes renais hipoclorêmicos,
verifique novamente as concentrações de cloreto com frequência e, uma vez que
os níveis de cloreto tenham sido corrigidos, use um cristaloide isotônico
tamponado (por exemplo, solução de Ringer com lactato ou Plasma-Lyte)
Hipocalcemia
Use gluconato de cálcio para tratar pacientes com
sinais clínicos de hipocalcemia (por exemplo, fraqueza, taquicardia e tremores)
A solução de Ringer com lactato contém uma quantidade muito pequena de cálcio e
não resolverá a hipocalcemia.
Hipercalcemia
Historicamente, 0,9% de NaCl tem sido recomendado
para calciurese em pacientes hipercalcêmicos, mas seus efeitos são geralmente
leves. Devido a preocupações com relação à lesão renal com 0,9% de NaCl,
considere usar um cristaloide isotônico balanceado em vez disso em pacientes
com risco de ou com doença renal atual
Tabela 12 A
Abordagem da Fluidoterapia em Pacientes
Hiponatrêmicos
|
1. A hiponatremia é aguda ou crônica?
|
|
Agudo
|
Crônico
|
|
A. Aumente a concentração sérica de sódio o mais rápido possível.
B. Administrar cristaloides isotônicos com concentração maior de
sódio que a concentração sérica do paciente
C. Verifique novamente as concentrações séricas de sódio 2–4 horas
após iniciar a terapia para avaliar a resposta terapêutica e, em seguida,
verificar novamente a cada 6–8 horas.
|
A. O cérebro leva de 24 a 48 horas para compensar a hiponatremia
B. Corrija a hiponatremia crônica lentamente para prevenir a síndrome
de desmielinização osmótica.
C. Aumentar a concentração sérica de sódio em não mais de 0,5 mEq/L/h
para uma correção total máxima de 10–12 mEq/L/dia.
|
|
2. O paciente apresenta sinais clínicos de hiponatremia?
|
|
A.Os sinais clínicos incluem vômitos, desorientação e convulsões
secundárias ao edema cerebral.
B. Se sintomático, tratar com solução salina hipertônica a 3, 5 ou
7,5% na dose recomendada de 2–6 mL/kg administrada durante 10–15 min.
C. Em pacientes humanos, aumentos de concentração sérica de sódio de
4–6 mEq/L são frequentemente suficientes para aliviar os sinais clínicos.
|
|
3. O paciente é hipovolêmico?
|
|
A.Realizar ressuscitação volêmica: 5-10 mL/kg (gatos) ou 15-20 mL/kg
(cães) administrados rapidamente durante 15-30 min com uma solução tamponada
capaz de expandir o espaço intravascular (Tabela 12c)
B. Repita conforme necessário até que os parâmetros de perfusão sejam
restaurados. Fluidos de manutenção ou hipotônicos (0,45% NaCl, 5% de dextrose
em água) têm baixas concentrações de sódio e não são indicados para tratar
hipovolemia
|
|
4. O paciente tem hiponatremia crônica sem sinais neurológicos?
|
|
A. Corrija lentamente a concentração de sódio a uma taxa máxima de
0,5 mEq/L/h ou 10-12 mEq/L/dia.
B. Tratar pacientes assintomáticos com restrição hídrica leve e
monitorar suas concentrações séricas de sódio.
C. Use a fórmula de Adrogue-Madias abaixo para calcular a mudança
esperada na concentração de sódio quando 1 L de uma solução específica de
fluido é administrado (ver Tabela 12c)
Alteração esperada na concentração sérica de sódio com 1 L de fluido
= Concentração de sódio no fluido ÿ concentração sérica de sódio / (água
corporal total + 1)
Onde água corporal total = peso corporal em kg × 0,6
|
Adrogue HJ, Tucker BM, Madias NE. Diagnóstico e
tratamento da hiponatremia: uma revisão. JAMA. 2022;328(3):280-91
Heinz J, Cook A. Avaliação e tratamento do paciente
com hiponatremia. Today's Veterinary Practice. 2022;12(2). 10 de fevereiro de
2022. Disponível em https:// todaysveterinarypractice.com/internal-medicine/evaluation-and-management-of-the-hyponatremic-paciente/.
Acessado em 4 de janeiro de 2024.
Tabela 12B
Causas comuns de hiponatremia aguda e crônica em
cães e gatos
|
Aguda
|
Crônica
|
|
• Consumption of large amounts of fresh water
leading to acute water intoxication
• Infusion of significant volumes of non
replacement fluids (por exemplo, administração de 5% destrose em solução para
reidratação paciente)
|
• Falha cadiaca congestiva
• Hipoadrenocorticismo
• Liver dysfunction
• Síndrome nefrótica
• Renal e gastrointestinal sodium loss
|
Tabela 12c
Concentração de Sódio em Cristaloides Isotônicos
|
Solução ringer com lactato
|
130 mEq/L
|
|
Plasma-Lyte A
|
140 mEq/L
|
|
Normosol R
|
140 mEq/L
|
|
NacL 0,9%
|
154 mEq/L
|
Evidências em pacientes humanos sugerem que 0,9% de
NaCl pode ser prejudicial à saúde renal
Ostermann M, Randolph AG. Composição do fluido de
ressuscitação e lesão renal aguda em doença crítica. New England Journal of
Medicine. 2022;386(9):888-889
Sigmon J, May CC, Bryant A, Humanez J, Singh V.
Avaliação de lesão renal aguda em pacientes neurologicamente lesionados
recebendo cloreto de sódio hipertônico: a carga de cloreto importa? Annals of
Pharmacotherapy. 2020;54(6):541-546.
Tabela 12D
Calculando as mudanças esperadas na concentração de
sódio
Heinz J, Cook A. Avaliação e tratamento do paciente
com hiponatremia. Today's Veterinary Practice. 2022;12(2). 10 de fevereiro de
2022 Disponível em https:// todaysveterinarypractice.com/internal-medicine/evaluation-and-management-of-the-hyponatremic-patient/.
Acessado em 4 de janeiro de 2024.
Tabela 13 A
Abordagem da Fluidoterapia em Pacientes
Hipernatrêmicos
|
1. A hipernatremia é aguda ou crônica?
|
|
Agudo
|
Crônico
|
|
• Use fluidos intravenosos hipotônicos para corrigir.
• Pode sofrer correção rápida da concentração de sódio sem risco de
edema cerebral
• Calcular o déficit hídrico livre e administrar em taxa apropriada
(veja #3 abaixo).
• Monitore as concentrações de sódio a cada 4-6 horas.
|
• O cérebro leva de 24 a 48 horas para compensar a hipernatremia.
• Corrija a hipernatremia crônica lentamente para prevenir edema cerebral
• Diminua a concentração sérica de sódio em no máximo 0,5 mEq/L/h
para uma correção total máxima de 10–12 mEq/L/dia (veja o item 3 abaixo).
|
|
2. O paciente é hipovolêmico?
|
|
Realizar ressuscitação volêmica com solução isotônica tamponada capaz
de expandir o espaço intravascular
• Fluidos de manutenção ou hipotônicos (0,45% NaCl, 5% dextrose em
água) têm baixas concentrações de sódio e não são indicados.
• Os fluidos listados na Tabela 12c são opções adequadas para tratar
a hipovolemia (5-10 mL/kg [gato] e 15-20 mL/kg [cão] administrados ao longo
15–30 minutos e repetido conforme necessário) até que os parâmetros de
perfusão sejam restaurados.
|
|
3. Cálculos para hipernatremia crônica e aguda
|
|
Estime a quantidade de água perdida (déficit de água livre).
Administre fluidos relativamente diluídos em comparação ao plasma.
Déficit de água livre (DHA) em litros (L) = [(Na do paciente/Na
desejado) -1] (0,6 Peso [kg])
|
Modifique o cálculo do déficit hídrico livre conforme a hipernatremia
seja aguda ou crônica, utilizando as fórmulas seguintes:
Tempo de substituição da FWD (h) para hipernatremia aguda = Paciente
Na ÿ Alvo Na1
Tempo de substituição da FWD (h) para hipernatremia crônica =
(Paciente Na ÿ Alvo Na) × 21
Em geral, reponha o déficit de água livre administrando 5% de
dextrose em água.
|
|
4. O paciente está desidratado?
|
|
• Tratar simultaneamente administrando um tampão cristaloide
isotônico (Tabela 12 c)
• Desidratação correta ao longo de 12–24 horas para minimizar as
mudanças no sódio.1
• Verifique novamente as concentrações de sódio a cada 4–6 horas para
evitar mudanças drásticas.
• Limite a ingestão de água até que o sódio do paciente esteja
próximo da concentração alvo.
|
Heinz J, Cook A. Avaliação e tratamento do paciente
com hiponatremia. Today's Veterinary Practice. 2022;12(2). 10 de fevereiro de
2022. https://todaysveterinarypractice.com/internal-medicine/evaluacion-and-management-of-the-hyponatrêmico-paciente/.
Acessado em 4 de janeiro de 2024.
Tabela 13 B
Causas comuns de hipernatremia aguda e crônica em
cães e gatos
|
Agudo
|
Crônico
|
|
Ingestão de grandes quantidades de
cloreto de sódio (ingestão de água salgada, massinha caseira ou sal)
|
perda de fluido hipotonico (diarreia,
peritonite, vomitos, doença renal)
|
|
Diabetes insipidus nefrogenico
|
|
Insolação
|
|
A infusão de fluidos hipertônicos
pode causar hipernatremia aguda ou crônica, dependendo da frequência com que
a concentração de sódio do paciente é verificada durante a hospitalização.
|
Estados
Vasodilatadores
Os pacientes podem apresentar sinais de má perfusão
ou choque (como taquicardia, hipotensão, pulsos periféricos fracos ou
concentrações elevadas de lactato) devido à vasodilatação generalizada, também
chamada de choque vasodilatador ou maldistributivo. No choque vasodilatador, há
dilatação excessiva dos vasos sanguíneos, levando a uma diminuição
significativa da pressão arterial e à perfusão inadequada dos órgãos vitais.80,81
Condições clínicas comuns que podem levar à vasodilatação incluem pancreatite,
anafilaxia, sepse, trauma e enterite parvoviral.
Historicamente, o tratamento do choque vasodilatador
tem girado em torno da administração rápida de fluidos, da administração de
antibióticos de amplo espectro, do estabelecimento do controle da fonte e do
uso de intervenções farmacológicas para manter a pressão arterial média
adequada.
Como distinguir entre choque hipovolêmico e
vasodilatador com base apenas em achados de exame físico é desafiador, e como
pacientes com choque vasodilatador podem ter algum grau de hipovolemia, um
desafio de fluidos é uma abordagem de tratamento razoável nessas situações.
Resposta pobre ou limitada a bolus de fluidos pode sugerir vasodilatação. Em
casos em que há uma resposta pobre à terapia de fluidos, a terapia vasopressora
deve ser considerada.82 Em pacientes com suspeita de anafilaxia, é crucial
administrar epinefrina, um vasopressor, o mais rápido possível.
Distúrbios de
Termorregulação
Hipotermia.
Sempre que possível, use fluidos quentes para
ressuscitação ou reidratação em pacientes hipotérmicos para reaquecimento ativo
do núcleo. A força-tarefa acredita que fluidos quentes irão pelo menos atenuar
o agravamento da hipotermia em comparação com a administração de temperatura
ambiente fluidos. Foi recomendado aquecer os fluidos intravenosos a 40–42
°C. Os fluidos podem ser aquecidos
usando vários métodos, incluindo imersão de tubos intravenosos em água morna,
aquecimento da bolsa de fluidos no micro-ondas, aquecedores de fluidos em linha
e pré-aquecimento de fluidos em um forno de convecção.85 No entanto, o efeito
de fluidos aquecidos na produção de um aumento na temperatura corporal é
controverso.
Hipotermia é comumente observada em gatos em choque.
A ressuscitação agressiva de fluidos com o objetivo de restaurar a pressão
arterial normal em gatos hipotensos e hipotérmicos frequentemente levará à
sobrecarga de fluido intersticial, edema pulmonar e derrame pleural. A
administração de volumes conservadores de fluidos (por exemplo, 5 mL/kg em
bolus IV por vez) concomitantemente ao reaquecimento ativo é uma parte
essencial da terapia de ressuscitação de choque em gato.
Hipertermia. A terapia com fluidos é importante no
tratamento da hipertermia em cães e gatos. Administrar fluidos em temperatura
ambiente pode auxiliar no resfriamento e maximizar a expansão do volume.
Hipoglicemia
Administre dextrose a pacientes que apresentem sinais
clínicos relacionados à hipoglicemia, como letargia, fraqueza, ataxia ou
convulsões. Para um bolus, use 0,5–1 mL/kg (0,25–0,5 g/kg) de dextrose a 50%,
que deve ser diluído na proporção de 1:2–1:4 e administrado em 2–5min.91 Na
maioria dos casos, o bolus deve ser seguido por um IRC de 1,25–5% de dextrose
(Tabela 14) até que o paciente consiga manter normoglicemia. A concentração de
dextrose instilada nos fluidos depende da gravidade da hipoglicemia do paciente
e da administração de fluidos. É aconselhável administrar concentrações de
dextrose superior a 5% através de uma linha central para evitar flebite. Note
que em pacientes com insulinoma, a administração de dextrose pode perpetuar a
hipoglicemia. Portanto, a dextrose deve ser administrada somente quando os
pacientes apresentam indicações clínicas de hipoglicemia, e a menor
concentração efetiva deve ser usada para prevenir a manifestação de sinais
clínicos.
Tabela 14
Como formular fluidos contendo dextrose
|
quantidade de solução de dextrose 50% adicionada
em 1 L de cristaloide isotônico
|
Concentração final de dextrose
|
|
25 mL
|
1,25%
|
|
50 mL
|
2,5%
|
|
100 mL
|
5%
|
Retire uma quantidade equivalente do fluido
cristaloide isotônico da bolsa antes de adicionar dextrose.
Seção 6:
Sobrecarga de fluidos
Três
principais lições
1. Primeiro,
não faça mal. A sobrecarga de fluidos é uma complicação potencialmente fatal
para a qual não existe terapia universalmente eficaz;
2. Administração
excessiva de fluidos iatrogênicos é a causa mais comum de sobrecarga de
fluidos. Prevenção e monitoramento vigilante são cruciais para mitigar os
riscos potenciais associados à terapia de fluidos
3. Pacientes
com função renal comprometida correm maior risco de sobrecarga de líquidos
devido à incapacidade dos rins de aumentar a produção de urina e excretar o
excesso de líquido de forma eficaz.
Visão geral
Sobrecarga de líquidos, ou intolerância a líquidos, é
um espectro clínico que abrange desde hipervolemia até edema com risco de vida
e derrames cavitários. A força-tarefa de diretrizes propôs que intolerância a
fluidos pode ser o termo mais apropriado para essa condição, pois esse termo
descreve com mais precisão como a quantidade de fluido necessária para
sobrecarregar um paciente depende de sua tolerância a uma determinada
quantidade de fluidos. “Intolerância a fluidos” também abrange tanto sobrecarga
iatrogênica quanto sobrecarga devido a comorbidades subjacentes. No entanto,
dado que “sobrecarga de fluidos” ainda é amplamente usada e reconhecida dentro
da profissão médica veterinária, será o termo principal usado nestes guias.
linhas para se referir a esta condição.
Todos os pacientes que recebem terapia de fluidos são
suscetíveis à intolerância a fluidos/ sobrecarga de fluidos; no entanto, a
administração excessiva é a causa mais comum de sobrecarga de fluidos. A
hipervolemia pode ser mais comum do que se percebe, pois os primeiros sinais de
aumento de peso corporal e balanço positivo de fluidos são difíceis de avaliar.
Normalmente, a hipervolemia é reconhecida quando ocorrem sinais avançados, como
edema e efusões.93 É importante entender os danos da sobrecarga de fluidos e a
necessidade de prevenir essa complicação, dada a eficácia limitada dos
tratamentos.
Reconhecendo e
gerenciando a sobrecarga de fluidos
Conforme discutido anteriormente, o movimento de
fluidos é influenciado pela pressão hidrostática, pressão oncótica e
permeabilidade vascular. Pacientes que recebem excesso de fluidos durante
ressuscitação, manutenção ou anestesia desenvolvem primeiro hipervolemia, o que
causa um aumento na pressão hidrostática. Uma diminuição na pressão oncótica pode
ocorrer com a diluição de proteínas plasmáticas associada à administração
excessiva de fluidos ou doença com perda de proteína. A hipervolemia, bem como
inflamação e lesão, podem danificar o glicocálice e aumentar a permeabilidade
vascular. Juntas, essas mudanças na dinâmica de fluidos promovem o movimento de
fluido para fora dos vasos para o espaço intersticial. À medida que o espaço
intersticial se expande, ele se torna mais complacente, acomodando maiores
quantidades de fluido intersticial, exacerbando ainda mais o problema da
sobrecarga de fluidos.
Mudanças na dinâmica dos fluidos que favorecem o
acúmulo de fluido intersticial são frequentemente vistas em combinação com a
resposta fisiológica do corpo ao estresse. Hipovolemia, doença e lesão levam à
retenção de água e sódio e aumento da sede. Essa resposta exacerba o risco de
sobrecarga de fluidos, pois fluidos de ressuscitação são administrados a
pacientes gravemente doentes quando seus corpos estão preparados para reter
fluidos.
No momento em que edema clínico ou efusões são
notados, edema interno também estará presente, o que pode impactar
negativamente a função do órgão (Figura 11).94 Uma vez que o edema tenha
ocorrido, é muito difícil reverter, mesmo com ultrafiltração. Assim, a
prevenção e o reconhecimento precoce são chaves para minimizar a morbidade e
mortalidade associadas à sobrecarga de fluidos.
Embora todos os pacientes que recebem fluidos IV
corram risco de sobrecarga de fluidos, aqueles com função renal prejudicada,
doença cardíaca ou doença hepática ou aqueles que recebem grandes volumes de
fluidos correm maior risco (Caixa 5). Animais de estimação com insuficiência
renal oligo-anúrica são particularmente suscetíveis à sobrecarga de fluidos
porque são incapazes de excretar o excesso de fluido. No entanto, esses
pacientes geralmente recebem terapia de fluidos agressiva, necessitando de
monitoramento rigoroso para ganho de peso, hipertensão (na presença de IRA/DRC)
ou sinais precoces de edema.
Para reduzir o
risco de sobrecarga de fluidos:
Use uma estratégia de baixo volume para ressuscitação
com fluidos. Adapte a fluidoterapia contínua para atender às necessidades de
cada paciente. Inclua todos os fluidos administrados como medicamentos,
infusões, lavagens e alimentação enteral para melhorar a precisão dos cálculos
de balanço de fluidos. Gatos e cães pequenos com volumes sanguíneos menores
podem rapidamente ficar sobrecarregados de fluidos se os clínicos não estiverem
atentos aos volumes administrados. Limite o volume total de fluido administrado
em pacientes anestesiados durante procedimentos longos. Como regra geral, os
pacientes que recebem fluidos anestésicos não devem receber mais do que o total
diário recomendado de 20 mL/kg/24 h.94 Considere a suplementação de água
enteral.
Para reconhecer a hipervolemia mais cedo, pese os
pacientes com frequência (a cada 6–12 horas) para identificar um aumento de 10%
no peso corporal em comparação com a linha de base inicial.93,94 Documente
regularmente todas as entradas e saídas de fluidos para ajudar a identificar o
balanço hídrico positivo. Sinais adicionais de sobrecarga de fluidos estão
resumidos na Tabela 15. Uma vez iniciado o edema, ele pode se tornar fatal e
muito difícil de resolver. Veja o Quadro 6 para equívocos comuns que podem
levar à sobrecarga de fluidos. Não há terapia definitiva. As abordagens
terapêuticas gerais incluem restrição de sódio e água, interrupção de fluidos
intravenosos, administração de diuréticos e aumento da mobilidade do paciente
(Figura 12). As intervenções e o sucesso dessas intervenções são limitados.
Portanto, a melhor abordagem é evitar a sobrecarga de fluidos.93,94
Figura 11
Impacto da sobrecarga de fluidos na função dos
órgãos
Caixa 5
Cenários comuns de casos de sobrecarga de fluidos
1. Terapia
de fluidos IV contínua em um paciente felino com doença renal. Um gato está
desidratado, urêmico e anúrico na apresentação. Embora a administração de
fluidos IV melhore o estado de hidratação, a uremia persiste. Os fluidos IV são
continuados com o objetivo equivocado de melhorar a TFG. No entanto, nenhum
aumento efetivo na TFG ocorrerá, não importa o quanto de fluido que esse
paciente recebe.
2.
Terapia de fluidos IV em um paciente anestesiado
para um procedimento longo. Um cão recebe 10 mL/kg de fluidos durante um
procedimento de 6 horas e desenvolve desconforto respiratório durante a
recuperação anestésica.
3. Terapia
de fluido SC em um gato com doença cardíaca oculta ou fulminante. Um gato se
apresenta para avaliação de vômito associado a mal-estar de insuficiência
cardíaca congestiva e recebe fluidos SC apesar de não haver evidência de
desidratação.
Tabela15
Achados clínicos, radiográficos e
ultrassonográficos associados à sobrecarga de fluidos
|
Resultados clínicos
|
Achados radiográficos
|
Achados ultrassonográficos
|
|
• Aumento do peso corporal (>10%)
• Edema tecidual (região intermandibular,
membros, patas, regiões dependentes, quemose)
• Secreção nasal serosa
• Secreção serosa do tubo endotraqueal em
pacientes anestesiados
• Aumento da frequência respiratória ou effort
• SPO2 reduzido
• Novo murmúrio, novo som de galope
• Sinais gastrointestinais (distensão abdominal,
vômitos, diarreia, inapetência, anorexia)
• Nenhuma alteração na pressão arterial;
hipertensão raramente associada à sobrecarga de fluidos, exceto em LRA/DRC.
|
• Edema da parede corporal
• Efusão pleural
• Edema pulmonar
• Cardiomegalia
• Artéria pulmonar aumentada
• Veia cava caudal aumentada
• Veia pulmonar aumentada
• Perda de detalhes serosos
• Intestinos distendidos
|
• Edema subcutãneo
• Efusão pleural
• Linhas B
• átrio esquerdo: aorta ampliado
• Veia cava caudal aumentada
• Diminuição da veia cava caudal
índice de colapsibilidade
• Ascite
• Espessamento da parede intestinal
• Íleo
• Mesentério hiperecoico e pâncreas
• Congestão hepática
• Edema da parede da vesícula biliar
• Edema perirrenal
|
Cole LP, Jepson R, Dawson C, Humm K. Hipertensão,
retinopatia e lesão renal aguda em cães: um estudo prospectivo [correção
publicada aparece no J Vet Intern Med.
Park S, Lee CJ, Lee M, et al. Efeitos diferenciais
da rigidez arterial e sobrecarga de fluidos na pressão arterial de acordo com a
função renal em pacientes com risco de doença cardiovascular. Hypertens Res.
2019;42:341–353. 2020 novembro;34(6):3168]. J Vet Estagiário Med.
2020;34(5):1940-1947
Caixa 6: Equívocos comuns que podem levar à
sobrecarga de fluidos
Mito: Fluidos intravenosos aumentam a TFG em
pacientes normalmente hidratados.
Correção: A administração de fluidos intravenosos
não aumentará a TFG em um paciente hidratado e euvolêmico.
Mito: A hipertensão pode ser usada para
diagnosticar hipervolemia.
Correção: Hipertensão raramente é associada com
hipervolemia ou edema. Alguns pacientes com doença renal podem desenvolver
hipertensão concomitante com hipervolemia.
Mito: Se um paciente estiver hipotenso, continue
dando bolus de fluidos até que a pressão arterial melhore.
Correção: Alguns pacientes hipotensos não
responderão à terapia de fluidos IV. Se um paciente não estiver respondendo à
terapia de fluidos, interrompa os bolus de fluidos e corrija quaisquer distúrbios
de eletrólitos ou glicose e considere o tratamento vasopressor
Mito: A hemodiálise é sempre uma opção de backup
para o tratamento da sobrecarga de líquidos se os diuréticos não funcionarem.
Correção: A hemodiálise tem um papel terapêutico
muito limitado no tratamento do edema porque o movimento do fluido do edema
para o espaço vascular é limitado.
Figura 12
Algoritmo de terapia de sobrecarga de fluidos
Se o paciente estiver apresentando:
|
 •
Aumento do peso corporal • Edema periférico leve ou localizado •
Aumento do peso corporal • Edema periférico leve ou localizado
|
• Dificuldade respiratória • Edema periférico
multifocal moderado a grave • Disfunção renal, hepática ou gastrointestinal

|
|
O paciente está superidratado

|
 O
paciente tem sobrecarga de fluidos O
paciente tem sobrecarga de fluidos
|
|
A interrupção dos fluidos intravenosos e o
aumento da mobilidade do paciente podem ser adequados
|
 Tratamento
ativo necessário Tratamento
ativo necessário
|
|
|
• Interromper fluidos
• Fornecer suporte de oxigênio • Administrar um
diurético
• Aumentar a mobilidade do paciente
• Remover o fluido pleural por toracocentese ou
ascite por abdominocentese
• Encaminhar o paciente para hemodiálise
• Considerar a interrupção dos inibidores da ECA
e BRAs para melhorar a TFG
|
Seção 7:
Perguntas e
controvérsias na terapia de fluidos
Três
principais conclusões
1. Fluidos são medicamentos com interações complexas
no corpo e exigem uma compreensão de como e quando prescrevê-los. Os clínicos
devem considerar cuidadosamente o estado de hidratação e volume, distúrbios
eletrolíticos e ácido-base e comorbidades subjacentes ao prescrever terapia de
fluidos.
2. Perguntas sobre a segurança dos coloides
sintéticos, a eficácia do plasma no tratamento da hipoalbuminemia, se os
fluidos contendo potássio são seguros no tratamento de pacientes hipercalêmicos
e se os fluidos intravenosos são indicados durante a ressuscitação
cardiopulmonar (RCP) são respondidas aqui.
3. As diretrizes do RECOVER Advanced Life Support
para RCP veterinária recomendam uma abordagem cuidadosa à prescrição de fluidos
em pacientes com parada cardiorrespiratória, devido à possibilidade de redução
do fornecimento de oxigênio aos tecidos miocárdico e cerebral em pacientes sem
hipovolemia ou choque distributivo.
Visão geral
A escassez de estudos prospectivos, cegos e em larga
escala sobre terapia de fluidos na medicina veterinária dá origem a questões e
controvérsias quanto à sua aplicação na prática. As decisões clínicas
frequentemente devem ser extrapoladas a partir dos dados limitados existentes,
contribuindo ainda mais para as discussões e incertezas em andamento em torno
da terapia de fluidos.
Os coloides
sintéticos são seguros?
Os coloides expandem rapidamente o espaço
intravascular e têm uma duração de ação mais longa do que os cristaloides. Seu
uso tem sido considerado há muito tempo como “poupador de volume” em comparação
com o volume de cristaloides necessário para corresponder ao seu efeito. Os
coloides sintéticos (por exemplo, amidos hidroxietílicos [mais comuns],
gelatinas e dextranos) estão mais prontamente disponíveis e são menos
dispendiosos do que as alternativas naturais de coloides, como hemoderivados ou
albumina específica da espécie. Apesar de sua atratividade inicial como fluidos
de ressuscitação, o uso de coloides sintéticos em pacientes animais de pequeno
porte gravemente enfermos é atualmente controverso devido a preocupações com
segurança e eficácia.96– 100 As complicações associadas ao seu uso em pacientes
humanos incluem o desenvolvimento de IRA e coagulopatia. Os coloides são
dissolvidos em NaCl, que fornece uma alta carga de cloreto ao túbulo distal e é
responsável por parte da insuficiência renal. efeitos observados em humanos. Há
evidências limitadas de que esses mesmos complicações podem ocorrer em cães e
gatos gravemente doentes, embora a maioria dos estudos sejam avaliações
retrospectivas ou pequenos estudos experimentais.101–120 Uma compreensão mais
recente da função da camada de superfície endotelial121 e a revisão da hipótese
de Starling122,123 levantaram preocupações de que o extravasamento dessas
macromoléculas sintéticas aumenta o edema do tecido e, em última análise, reduz
o fornecimento de oxigênio em estados de maior permeabilidade vascular, como
ocorre com a síndrome da resposta inflamatória sistêmica, sepse, trauma e
outros danos à camada de superfície endotelial.124 Não há consenso baseado em
evidências sobre o uso ideal de coloides sintéticos em pequenos animais.
Existem muito poucas evidências sobre se um coloide sintético é mais seguro ou
mais eficaz do que outro. Os médicos devem pesar cuidadosamente o risco versus
o benefício para pacientes individuais.
Considere o seguinte antes de administrar colóides
sintéticos:
- Evite coloides sintéticos se o paciente responder a
terapias cristaloides ou alternativas
- Coloides sintéticos não devem ser usados como
substitutos para albumina. Em casos de hipoalbuminemia grave, coloides naturais
como produtos de plasma ou albumina devem ser considerados.
- Em processos de doenças complexas, como sepse ou
choque séptico, o tratamento é multimodal e pode envolver colóides naturais
e/ou vasopressores
- Evidências atuais sugerem um risco mínimo de IRA
associada a coloides sintéticos em cães e gatos quando administrados em
pequenas doses (20 mL/kg) por curtos períodos. vasopressores. - Não é
aconselhável administrar coloides sintéticos a pacientes hemodinamicamente estáveis
e àqueles com azotemia preexistente.
- Coloides sintéticos podem ser considerados para
necessidade de curto prazo de suporte de pressão osmótica coloidal (por
exemplo, durante anestesia para ligadura de derivação portossistêmica em um
paciente com hipoalbuminemia).
As recomendações atuais para administração de
coloides sintéticos incluem minimizar a dose e a duração, monitorando de perto
a função renal (até 90 dias após a exposição), os parâmetros de coagulação, o
hematócrito e a contagem de plaquetas.100 Os coloides sintéticos devem ser
evitados ou usados com cautela em pacientes com azotemia preexistente.
coagulopatia, anemia e trombocitopenia.100 Alguns clínicos veterinários também
consideram a hipertensão sistêmica e a sepse como contra-indicações para o uso
de colóides sintéticos.
O plasma pode
ser usado para tratar hipoalbuminemia?
Uma concentração sérica de albumina de 2,0 g/dL é um
indicador prognóstico negativo associado ao aumento da morbidade e mortalidade
de pacientes em pequenos animais devido ao desenvolvimento de edema periférico,
perfusão e oxigenação tecidual prejudicadas, hipercoagulabilidade, metabolismo
alterado de medicamentos ligados a proteínas e má cicatrização de feridas. Em
geral, coloides naturais (por exemplo, albumina e plasma) são preferidos aos
coloides sintéticos para tratar a hipoalbuminemia, mas eles permanecem
controversos devido à falta de evidências que relacionem a correção da
concentração de albumina com melhores resultados em pacientes veterinários
gravemente enfermos56,125,126 Produtos de albumina específicos da espécie são
os produtos de transfusão recomendados em pacientes veterinários com
hipoalbuminemia grave ou piorando.61,125 Devido à disponibilidade e ao custo
limitados da albumina específica da espécie, produtos de plasma (por exemplo,
plasma fresco congelado, plasma congelado e CPP) são algumas vezes usados para
tratar a hipoalbuminemia em cães e gatos.127 Embora os produtos de plasma
contenham quantidades variáveis de albumina,59 as complicações das transfusões
de plasma parecem ser menos arriscadas do que a xenotransfusão com produtos de
albumina humana.125,128–131 A necessidade de volume e o custo do plasma para
aumentar a concentração de albumina sérica são uma limitação séria em seu uso
para tratar a hipoalbuminemia. Para muitos pacientes, o suporte nutricional é
mais eficaz, menos desafiador, menos arriscado e menos dispendioso do que
tentar aumentar a albumina sérica diretamente com colóides naturais.
Os cristais
isotônicos “balanceados” contendo potássio são prejudiciais em pacientes
hipercalêmicos?
A hipercalemia é um distúrbio eletrolítico comum em
pacientes de pequenos animais com condições como obstrução uretral ou ureteral
bilateral, ruptura da bexiga, hipoadrenocorticismo (cães), insuficiência renal
anúrica ou oligúrica e outras.134 Muitos desses pacientes necessitam de
ressuscitação volêmica, e os médicos devem escolher entre administrar fluidos
sem potássio (por exemplo, NaCl a 0,9%) ou solução eletrolítica isotônica
balanceada (por exemplo, solução de Ringer com lactato, Normosol-R e
Plasma-Lyte A).
Soluções eletrolíticas isotônicas balanceadas para
ressuscitação contêm apenas uma pequena quantidade de potássio (4–5 mEq/L)
(Tabela 8). Vários estudos concluíram que fluidos isotônicos contendo potássio
não são prejudiciais para ressuscitação e reidratação de fluidos em gatos
hipercalêmicos com obstrução uretral.135,136 Fluidos isotônicos balanceados
corrigir desequilíbrios ácido-base mais rápido do que um fluido acidificante,
como NaCl a 0,9%. Cristaloides isotônicos balanceados também ajudam a prevenir
a correção excessivamente rápida de sódio em pacientes hiponatrêmicos que têm
hipercalemia (por exemplo, crise addisoniana).137 É fundamental identificar e
tratar a causa subjacente da hipercalemia. Tratamento adicional de casos graves
A hipercalemia é indicada para prevenir distúrbios de condução cardíaca e
outras complicações fatais quando o potássio sérico é de 0,7 mmol/L.
Fluidos
intravenosos são indicados durante a RCP?
A fluidoterapia é indicada durante a RCP se ajudar a
mitigar a hipovolemia que levou à parada cardiopulmonar. A fluidoterapia
intravenosa na forma de bolus cristaloides aumenta a pré-carga e o aporte
cardíaco em pacientes de pequenos animais com hipovolemia ou vasodilatação
inapropriada (por exemplo, anafilaxia, sepse e síndrome da resposta
inflamatória sistêmica). Aumentar o volume intravascular em pacientes
euvolêmicos, no entanto, pode, em última análise, diminuir as pressões de
perfusão e reduzir o fornecimento de oxigênio aos tecidos miocárdico e
cerebral.139–142 Por esse motivo, as diretrizes do RECOVER Advanced Life
Support para RCP veterinária defendem uma abordagem cuidadosa à prescrição de
fluidos em pacientes com parada cardiopulmonar. Essas diretrizes recomendam
fluidos apenas para indicações específicas, como pacientes com ou com
probabilidade de ter hipovolemia ou choque distributivo.143,144 Estudos
experimentais em ratos e porcos sugerem que pode haver um efeito neuroprotetor
associado à solução salina hipertônica administrada durante a RCP,145–147 mas
faltam evidências clínicas em cães e gatos com parada cardiopulmonar.
Coloides sintéticos devem ser evitados nesses
pacientes devido aos riscos potenciais e à ausência de um benefício de
sobrevivência para justificar os riscos.144 Pacientes com hemorragia
significativa podem necessitar de hemoderivados. Pacientes com distúrbios no
potássio, cálcio, magnésio, glicose ou estado ácido-base podem se beneficiar de
terapia direcionada para ajudar a corrigir anormalidades fatais. Pacientes com
toxicoses lipossolúveis agudas podem se beneficiar de terapia de emulsão
lipídica IV.
Seção 8:
Administração e monitoramento de fluidos
Três
principais conclusões
1. Usar
técnicos veterinários qualificados para administrar e monitorar a terapia de
fluidos permite que o veterinário se concentre nas tarefas que ele deve
executar sozinho (ou seja, diagnosticar, prescrever — incluindo a prescrição da
terapia de fluidos —, prognóstico e cirurgia), levando ao aumento da eficiência
e supervisão dos pacientes.
2.
O monitoramento durante a terapia de fluidos
intravenosos é fundamental para evitar sobrecarga de fluidos. Quando o
monitoramento do paciente ou o encaminhamento para um hospital que ofereça
monitoramento não estiver disponível, considere uma via alternativa de parto.
3.
As bombas de infusão são frequentemente
utilizadas; no entanto, nem sempre são os método ideal para administração de
fluidos.
Visão geral
Fluidos IV podem ser administrados de várias
maneiras. A equipe de enfermagem veterinária deve ser treinada em como usar
cada método para evitar sobrecarga de fluidos em pacientes e riscos potenciais
relacionados. Esses fatores ajudam a determinar o melhor modo para
administração de fluidos IV:
Volume a ser infundido
Duração total da infusão
Nível de monitoramento disponível durante a
administração
Tipo de fluido administrado
Administração
de Fluidos
Bombas de infusão intravenosas são mais comumente
usadas, mas nem sempre são o modo ideal de administração. Por exemplo, um cão
grande que precisa de uma infusão rápida de cristaloides pode precisar de uma
taxa de infusão que exceda 1–2 L/h que as bombas padrão fornecem. Nesse caso,
uma bolsa de pressão seria o método preferido para fornecer o grande volume de
fluido em um curto espaço de tempo. Para animais que recebem um pequeno volume
de fluidos, uma bomba de seringa pode ser mais precisa do que uma bomba de
infusão padrão que não tem microconfigurações (Tabela 16).
O conjunto de administração IV é outra consideração
na escolha do equipamento. Animais menores podem se beneficiar de um conjunto
de micro gotejamento (60 gotas/mL), que fornece uma administração de fluidos
mais precisa. Isso pode ser especialmente útil ao usar o método de gravidade
para administrar fluidos em pacientes pequenos. Os conjuntos de macro
gotejamento vêm em uma variedade de fatores de gotejamento; os mais usados na
medicina veterinária são 10 gotas/mL e 15 gotas/mL. As bombas de fluidos também
são geralmente projetadas para uso com um tipo ou tamanho específico de tubo,
por isso é importante combiná-los para garantir uma administração adequada de
fluidos (Tabela 16). Use uma nova linha IV e bolsa para cada paciente148 (veja
a Tabela 17 para cuidados e posicionamento do cateter IV). Prepare as linhas IV
com o fluido a ser infundido antes do uso para evitar embolia gasosa. Uma porta
T pode facilitar a administração de medicamentos, e uma porta Y pode ser usada
ao administrar mais de uma infusão compatível.
Bolsas de fluidos intravenosos não devem ser usadas
para lavagens salinas devido a o risco de contaminação. Seringas pré-cheias
comerciais são preferidas para diminuir as chances de introdução de
contaminação bacteriana que pode levar à infecção.
Se o acesso IV não for possível, considere cateteres
IO no início do tratamento para evitar atrasos na ressuscitação de fluidos. Os
dispositivos IO são capazes de perfurar rapidamente o osso, mas exigem
treinamento. Quando nenhum dispositivo estiver disponível, agulhas ou cateteres
IV periféricos podem ser usados (consulte https:// www.youtube.com/watch?v=10twNYP1pB0
para obter instruções sobre como colocar um cateter IO).
Monitoramento
de Fluidos
A equipe de enfermagem treinada deve monitorar
continuamente a administração de fluidos IV (Tabela 18). Sem monitoramento
adequado, consequências graves podem ocorrer e comprometer o atendimento ao
paciente. Use o monitoramento multiparâmetro para obter uma imagem ampla do
volume e do estado de hidratação do paciente e evitar complicações relacionadas
a fluidos (Tabela 19). Bombas de infusão intravenosas são mais comumente
usadas, mas nem sempre são o modo ideal de administração. Por exemplo, um cão
grande que precisa de uma infusão rápida de cristaloides pode precisar de uma
taxa de infusão que exceda 1–2 L/h que as bombas padrão fornecem. Nesse caso,
uma bolsa de pressão seria o método preferido para fornecer o grande volume de
fluido em um curto espaço de tempo. Para animais que recebem um pequeno volume
de fluidos, uma bomba de seringa pode ser mais precisa do que uma bomba de
infusão padrão que não tem microconfigurações (Tabela 16). 157 Monitore
pacientes com alto risco de sobrecarga de fluidos pelo menos a cada 2 horas
(veja as Tabelas 19 e 20 para métodos). Pese esses pacientes 2–3 vezes ao dia,
verifique sua frequência respiratória a cada 1–2 horas, meça a quantidade de
fluidos entradas e saída de urina, e observe os sinais de edema. Se disponível
realizar ultrassonografia focalizada para resposta a fluidos, o que inclui a
varredura de derrame cavitário e linhas B nos pulmões e avaliando a veia cava.
Para pacientes com risco de recorrência de choque hipovolêmico, avaliar a veia
cava inferior pode ser uma melhor indicador de recorrência do que outros
parâmetros mais comumente monitorados, como frequência cardíaca e pressão
arterial.
Em pacientes menores, especialmente pediátricos,
tenha em mente que a série a coleta de sangue pode diminuir o volume sanguíneo.
Utilizando totalmente os técnicos veterinários, que
não só podem configurar e executar a terapia de fluidos, mas também identificar
os sinais de complicações relacionadas a fluidos, permite ao veterinário
delegar esta tarefa de enfermagem após prescrevendo ordens de terapia de
fluidos. Quanto mais forte for a compreensão do técnico veterinário sobre o
“porquê” da terapia de fluidos, algo que é abordados em programas de tecnologia
veterinária e enfermagem, mais eles podem ser otimizados em seu potencial
máximo, permitindo maior eficiência da equipe veterinária.
Muitas clínicas veterinárias não conseguem fornecer
atendimento 24 horas atendimento ou geograficamente incapaz de encaminhar
pacientes para uma unidade 24 horas. Quando o monitoramento contínuo do
paciente não é possível, a força-tarefa recomenda administrar fluidos
intravenosos durante o horário de funcionamento da clínica e SC fluidos antes
de sair para a noite. Uma taxa de fluido IV ligeiramente mais alta pode ser
usado durante o dia, a menos que seja contra-indicado devido à estado de doença
do paciente. O monitoramento do paciente deve ser fornecido sempre que forem
administrados fluidos IV.
Tabela 16
Modos de administração de fluidos intravenosos
|
Método de entrega
|
Considerações
|
|
Bomba de fluido
|
• Limites de taxas de administração muito altas e, possivelmente,
muito baixas • A taxa máxima de administração pode limitar a capacidade de
administrar rapidamente um bolus com grandes volumes de fluido
|
|
Bomba de seringa
|
• Limitado a pequenos volumes
• Fixe o conjunto de extensão próximo ao cateter IV para garantir que
o paciente receba a infusão em tempo hábil
|
|
Conjunto de gotejamento por gravidade
|
• É necessário calcular a taxa de gotejamento: Taxa de fluido (mL/h)
× Fator de gotejamento (gtt/mL)/3600 = gtt/s
• A movimentação do paciente ou alterações na colocação da bolsa
podem afetar a taxa de gotejamento
• O monitoramento próximo é essencial porque não há alarmes
|
|
Buretrol
|
• Usado em conjunto com uma bomba de fluido
• Impede a administração de grandes volumes de fluidos a pacientes
pequenos
• Permite volumes menores de aditivos, levando a menos desperdício em
pacientes menores ou em casos de mudanças nos planos de fluidos
|
|
Seringa
|
• Administração manual de pequenos volumes
• Não deixe preso a um paciente enquanto ele estiver sozinho
|
|
Bolsa de pressão
|
• Ideal quando o volume a ser infundido ao longo de um determinado
período excede as capacidades de uma bomba de fluido e de um conjunto de
gravidade
|
Tabela 17
Lista de verificação de colocação e cuidados com
cateter intravenoso periférico
|
Grande furo/ calibre, cânula curta
|
• Cateteres curtos e de calibre maior oferecem menos resistência ao
fluxo sanguíneo do que cateteres de calibre maior e menor. Ideal para ter à
mão caso surja a necessidade de infusão rápida.
|
|
Preparação e cuidados assépticos
|
• Veja o protocolo de Diretrizes de Controle de Infecção, Prevenção e
Biossegurança da AAHA para cateteres IV em www.aaha.org/resources/
2018-aaha-infection-control-prevention-and-biosecurity-guidelines
|
|
Cateter seguro
|
• Fixe o primeiro pedaço de fita no cateter como uma âncora. Use a
menor quantidade de fita possível e prenda as pontas da fita para facilitar a
remoção.
• Use material de curativo adicional conforme necessário. Tenha
cuidado para não prender muito apertado ou muito solto para evitar inchaço ou
deslocamento prematuro
|
|
Manutenção diária
|
• Verifique os cateteres pelo menos duas vezes por dia. Desembrulhe
completamente o material de curativo que cobre a fita, examine o local do
cateter para sinais de inchaço ou tromboflebite. Remova o cateter e coloque
outro se indicado.
• Evidências em pacientes humanos mostram que a substituição
rotineira do cateter não oferece nenhum benefício em relação substituição de
cateteres periféricos quando clinicamente indicado
|
|
Limpe as portas quando desconectado
|
• Limpe as portas com álcool isopropílico
• Portas de injeção e conexão sem agulha são preferidas.
|
Reddick AD, et al. Ressuscitação com fluidos
intravenosos: Poiseuille estava certo? Emerg Med J. 2011;28(3):201-2. Lista de
verificação de colocação e cuidados com cateter intravenoso periférico Modos de
administração de fluidos intravenosos
Webster J, Osborne S, Rickard CM, Marsh N.
Substituição clinicamente indicada versus substituição de rotina de cateteres
venosos periféricos. Cochrane Database Syst Rev. 2019;1(1):CD007798.
Tabela 18
Monitoramento da administração de fluidos
|
Método de Entrega
|
Monitoramento
|
|
Bomba de fluido
|
• Defina volume total infundido para 0 no início. Documente a cada
2-4 horas.
• Defina volume a ser infundido para o período entre cheques
|
|
Bomba de seringa
|
• Defina volume total infundido para 0 no início. Documente a cada
2-4 horas.
• Defina volume a ser infundido para o período entre cheques
|
|
Bolsa de pressão
Conjunto de gotejamento por gravidade
|
• Marque a parte superior dos fluidos na bolsa no início e documente
a cada 1–2 horas.
• Monitore com mais frequência devido ao maior risco de alterações no
volume administrado (por exemplo, a cada cinco minutos para volumes
administrados durante mais de 15-20 minutos).
|
|
Seringa
|
• Use apenas para administração em bolus. Não deixe preso ao paciente
|
Tabela 19
Parâmetros de avaliação e monitoramento que podem
ser usados para pacientes recebendo terapia de fluidos
• Taxa e qualidade de pulso
• Tempo de recarga capilar
• qualidade das mucosas
• Frequência e esforço respiratório
• Sons pulmonares
• Tugor cutâneo
• Peso corporal
• Débito de urina
• Estado mental
• Temperatura de extremidade • Volume
celular/sólidos totais • Proteína total • Soro lactato • Gravidade urinária •
Ureia e nitrogênio no sangue • Creatinina • Eletrólitos • PAS • Gases venosos e
arteriais • Saturação de O2Incluindo ausculta cardíaca para identificar novos
sopros
Reimpresso de Davis H, Jensen T, Johnson A, et al.
2013 AAHA/AAFP fluidoterapia diretrizes para cães e gatos. J Am Anim Hosp
Assoc. 2013;49(3):149-59.
Tabela 20
Métodos para monitorar entradas e saídas de fluidos
Produção de urina
• Cateter urinário com sistema de coleta fechado
• tapetes absorventes
• Coleta de urina de cateter livre durante
caminhadas
Volume estimado de vômito e diarreia
Tubo de alimentação
• Quantidade entregue
• Quantidade de conteúdo residual no estômago
Peso corporal
Saída de drenagem
Seção 9: Conclusão
A administração de fluidos é a base da terapia para
muitos pacientes caninos e felinos. Pacientes que precisam de suplementação de
fluidos requerem um plano de terapia de fluidos personalizado que garanta a
administração do fluido adequado na taxa e volume apropriados. Confiar em uma
estratégia de "taxa única para a maioria dos pacientes" nos cálculos
de terapia de fluidos não é apenas impraticável, mas também potencialmente prejudicial.
Entender as diferenças entre os tipos de fluidos e seus efeitos dentro dos
compartimentos de fluidos do corpo é crucial, juntamente com uma avaliação
cuidadosa e abrangente do paciente. As prescrições de terapia de fluidos
direcionadas abordam os requisitos de ressuscitação, reidratação e manutenção
de cada paciente. A terapia de fluidos também envolve a antecipação das
mudanças nos eletrólitos e outros parâmetros biológicos que ocorrerão como
resultado da terapia de fluidos e suplementação de fluidos ou alteração do
plano de tratamento para evitar efeitos adversos. O monitoramento diligente do
paciente é essencial para avaliar a resposta terapêutica, indicando quando
mudanças nos planos de terapia de fluidos são necessárias para otimizar os
resultados do paciente.