As figuras e alguns comentários nessa publicação foram acrescentadas por mim, baseadas em outras literaturas.
resumo
A hemodiálise intermitente (IHD) é um padrão avançado de
tratamento adjuvante para lesão renal aguda grave (LRA) e outras indicações. A
maioria dos animais com LRA é tratada clinicamente, no entanto, quando a doença
é grave, o tratamento médico pode não controlar as consequências da doença, e
os animais com potencial para recuperação renal podem morrer das consequências
da uremia antes que a recuperação ocorra. As terapias extracorpóreas auxiliam
no tratamento da LRA ao expandir a janela de oportunidade para a recuperação da
função renal suficiente para se tornar independente da diálise. A hemodiálise
intermitente (IHD) foi introduzida na medicina veterinária há mais de 50 anos,
no entanto, as diretrizes atualizadas para a administração de IHD não foram publicadas
por várias décadas. Para esse fim, a International Renal Interest Society
(IRIS) constituiu um Grupo de Trabalho para estabelecer diretrizes de melhores
práticas para a administração segura e eficaz de IHD a animais com indicações
para intervenção dialítica. O Grupo de Trabalho IRIS gerou 60 declarações de
consenso e fundamentação de apoio para um espectro de categorias de prescrição
e gerenciamento necessárias para a administração de IHD em plataformas
designadas de diálise intermitente (ou seja, LRA, hemodiálise crônica e
intoxicações). Um método de consenso formal foi usado para validar as
recomendações por um júri cego de 12 veterinários considerados especialistas em
terapias extracorpóreas e realizando IHD ativamente. Cada voto forneceu um nível
de concordância para cada recomendação proposta pelo Grupo de Trabalho. Para
atingir um consenso, um mínimo de 75% dos participantes votantes tiveram que
"concordar fortemente" ou "concordar" com a recomendação.
Palavras-chave: Lesão renal aguda; Canino; Extracorpóreo;
Felino; Hemodiálise.
Introdução
A hemodiálise intermitente (IHD) é um padrão avançado de
tratamento adjuvante para lesão renal aguda grave
(LRA) e outras indicações nas quais a terapia médica falha em corrigir azotemia com
risco de vida, sobrecarga de fluidos ou composição desregulada de fluidos corporais ou
intoxicações. A lesão
renal aguda grave (LRA) está associada a alta morbidade e
mortalidade com mortalidade relatada de 35%-60% em animais tratados
clinicamente ou com hemodiálise. O tratamento médico sozinho geralmente é ineficaz
para controlar os sinais clínicos e as anormalidades metabólicas da uremia
quando a LRA é grave. Consequentemente, os animais correm o risco de morrer
dentro de uma janela terapêutica curta , apesar da potencial
reversibilidade da LRA. A hemodiálise adjuvante deve ser introduzida em tempo
hábil ao tratamento médico, quando não se espera que o tratamento médico
sozinho controle os sinais clínicos e as anormalidades clinicopatológicas
mórbidas associadas à LRA. A hemodiálise também é indicada para eliminação de
toxinas selecionadas em casos de intoxicações independentes da função renal.
Nessas circunstâncias, uma avaliação cuidadosa deve ser realizada para
determinar se a intervenção dialítica é indicada (por exemplo, nível de
toxicidade, meia-vida da toxina, disponibilidade de antídoto) e se espera que a
hemodiálise remova efetivamente a toxina.
As
modalidades para a administração de terapia de substituição
renal incluem diálise
peritoneal , IHD e terapia de substituição
renal contínua (CRRT). Nas últimas décadas, as
terapias de substituição renal extracorpórea tornaram-se
mais amplamente disponíveis na medicina
veterinária . A IHD foi a primeira terapia
de substituição renal extracorpórea introduzida na terapêutica veterinária e
continua sendo uma opção de tratamento avançado eficaz para LRA com aceitação
crescente. Apesar de sua integração estabelecida na terapêutica veterinária,
são necessárias diretrizes veterinárias atualizadas para as indicações,
prescrição e administração de IHD com base em evidências de alto grau da
literatura veterinária ou humana, ou opinião de especialistas considerados.
A
International Renal Interest Society (IRIS) reconheceu essa necessidade e
comissionou um Grupo de Trabalho para estabelecer diretrizes de melhores
práticas para animais tratados com IHD. As diretrizes resultantes foram
adaptadas para tratamentos intermitentes usando plataformas IHD, a menos que
especificamente indicado de outra forma. As diretrizes refletem a opinião
consensual com base na literatura humana ou veterinária atual, revisão de material
de caso e experiência clínica dos membros do Grupo de Trabalho IRIS.
A bomba de sangue arterial bombeia o sangue do
acesso vascular do paciente para o dialisador. A pressão do lado de aspiração
da bomba é medida e monitorizada por um monitor de pressão arterial, o qual se
encontra separado por um filtro hidrofóbico. Se a pressão exceder ou se cair
para valores abaixo dos limites estabelecidos, será emitido um alarme de
sangue: a bomba de sangue arterial para, o clamp da linha venosa fecha e é
emitido um alarme acústico e visual. A ultrafiltração para. A bomba de heparina
é utilizada para administrar doses de heparina no sangue a uma taxa ajustável.
Depois do dialisador, o sangue entra na câmara venosa. Aqui, a pressão venosa
de retorno é medida e monitorizada dentro de limites restritivos. O monitor
para a pressão venosa de retorno encontra-se separado por dois filtros
hidrofóbicos. A câmara venosa está localizada no detector de ar. Este constitui
uma proteção contra a infusão de ar. Se o nível baixar ou se existir espuma de
sangue na câmara venosa, é emitido um alarme de sangue: a bomba de sangue
arterial para, a mola da linha venosa fecha e é emitido um alarme acústico e
visual. A ultrafiltração para. Após a câmara venosa, o sangue passa pelo
detector óptico (OD), que efetua a diferenciação do seguinte modo:
– OD claro (solução salina ou ar na linha) ou
– OD escuro (sangue na linha).
A partir do detector óptico, o sangue é
devolvido ao paciente (agulha venosa)
Metodologia
Essas
diretrizes clínicas foram desenvolvidas por um Grupo de Trabalho da IRIS,
incluindo seis médicos internistas certificados com treinamento formal e ampla
experiência em IHD . O
Grupo de Trabalho gerou recomendações abrangentes para a prescrição e
administração de IHD para cães e gatos .
Uma vez concluído esse processo, um método de consenso formal foi usado para
validar as recomendações em duas etapas: 1) As declarações foram distribuídas
para todo o Conselho da IRIS, que revisou as declarações de consenso e fez
comentários e sugestões. Elas foram discutidas posteriormente pelo Grupo de
Trabalho e as declarações foram revisadas conforme apropriado. 2) Doze
veterinários com ampla experiência
extracorpórea e realizando IHD ativamente
foram solicitados a revisar as declarações, enviar comentários e, finalmente,
votar com base em seu nível de apoio usando a seguinte escala: "concordo
totalmente", "concordo", "neutro", "discordo"
ou "discordo totalmente". O anonimato foi mantido enviando todas as
cédulas a uma parte independente que encaminhou os resultados assim que o
processo de votação foi concluído. Para que uma diretriz obtivesse aprovação
por consenso, um mínimo de 75% dos participantes votantes tiveram que escolher
"concordo totalmente" ou "concordo". Esses resultados são
relatados junto com cada recomendação de diretriz como uma avaliação da força
do consenso para a diretriz. As diretrizes de consenso são destacadas em texto
em negrito. O texto que não está em negrito é fornecido como título, contexto
ou racional, mas não é per se uma
recomendação de diretriz de consenso.
Resultados
Momento do início da
diálise em cães e gatos com lesão renal aguda
A
hemodiálise intermitente é uma modalidade eficaz para a remoção de toxinas urêmicas retidas,
cargas excessivas de fluidos e correção de distúrbios metabólicos em animais
com LRA de grau IV e V da IRIS. No entanto, quando é aplicada tardiamente
no curso da doença ,
ou quando complicações multiorgânicas estão presentes, a hemodiálise tem menos
probabilidade de alterar o resultado da LRA. As toxinas urêmicas
são distribuídas por todos os fluidos corporais e afetam essencialmente todos
os órgãos do corpo. Posteriormente, os animais correm o risco de morrer de
disfunção de múltiplos órgãos se o tratamento de diálise for adiado. Foi demonstrado que
o número de órgãos afetados secundariamente por uma LRA está associado ao
aumento progressivo da mortalidade. A intervenção dialítica deve ser aplicada
proativamente antes da falência de múltiplos órgãos e não como uma resposta a ela.
Declaração: A intervenção dialítica é
indicada em animais com IRA ou doença renal aguda sobre crônica, quando se
espera que a uremia e as toxinas de uremia retidas causem disfunção
metabólica ou orgânica grave ou danos que levem à disfunção multiorgânica. A
intervenção dialítica deve ser direcionada para prevenir (preferencialmente) em
vez de resolver ou melhorar a morbidade estabelecida ou disfunção orgânica
sistêmica secundária à lesão renal. As principais indicações
para intervenção dialítica na IRA são:
Creatinina sérica excedendo 5 mg/dL (442 µmol/L) e tendendo a ser mais alta em um
animal hidratado.
Anúria persistente (>6 h) ou oligúria (<0,3 mL/kg/h) que não responde à
fluidoterapia e ao tratamento médico adequados.
Hidratação excessiva grave e com risco
de vida, que não responde à terapia diurética e promove danos aos órgãos-alvo.
Presença de distúrbios eletrolíticos que não podem ser controlados com
tratamento médico ou cirúrgico (por exemplo, hipercalemia grave o suficiente para
comprometer a função cardíaca).
(100% de concordância)
A subsequente diminuição aguda da taxa de
filtração glomerular leva ao acúmulo de toxinas urêmicas e resíduos metabólicos
no sangue, resultando em desregulação do equilíbrio de fluidos, eletrólitos e
ácido-base. Um algoritimo de diagnósticos pode ser usado para estabelecer a
definição clínica de LRA como:
-
Início agudo
dos sinais clinicos <7dias;
-
Aumento da
creatinina ou dos níveis de BUN, mesmo com a correção de fluidos frente a uma
azotemia pre renal
Critérios de suporte para o diagnóstico de LRA;
-
Creatinina
normal conhecida no ultimo mês;
-
Isquemia
recente conhecida ou ingestão de nefrotóxicos;
-
Confirmação
morfológica de lesões renais agudas
-
Retorno da
creatinina aos valores normais
Em cães, as causas mais comuns de LRA incluem
isquemia e ingestão de toxinas. Os eventos isquêmicos podem ser causados por
pancreatite, hipovolemia, sepse, coagulopatia intravascular, procedimentos
hospitalares (anestesia geral) ou outras causas. Já no exterior os eventos
nefroxicos são a ingestão de etilenoglicol, mas também outras toxinas como uva,
uva passas, antibióticos aminoglicosídeos, agentes quimioterápicos como
cisplatina, ciifosfamida e medicamentos antiinflamatórios não esteróides. A leptospirose
é uma doença comum de LRA em cães, e aqui na nossa região metropolitana de BH
as doenças transmitidas por vetores.
Em gatos, as causas mais comuns de LRA incluem
lesões tóxicas e isquêmicas, O nefrotóxico comumente infgerido em gatos é a
planta lírio dos gêneros Lilium e Hemerocallis, embora LRA tenha sido relatada
por ingestão de etilenoglicol, bem como uma variedade de medicamentos como
antibióticos aminiglicosídeos, AINES e agentes quimioterápicos, obstrução
ureteral parcial ou completa pode levar a insuficiência renal aguda.
Em cães e gatos, pielonefrite bacteriana,
obstrução uretral, uretral ou do trato urinário pode causar LRA. A pielonefrite
bacteriana é causada por infecção do trato urinário inferior, mas pode ser causada
por infecção hematogênica. O manejo inicial de lesões agudas ou agudas sobre
crônicas inclui administração de fluido intravenoso, correção da hipovolemia,
correção de minerais, eletrólitos e desequilíbrios ácido-base, tratamento de
suporte dos sinais clínicos de uremia e suporte nutricional. O tratamento
também inclui a remoção da causa desencadeante da lesão renal, se possível.
Muitas causas de LRA são potencialmente reversíveis, os animais podem morrer de
complicações da uremia antes que ocorra uma recuperação renal suficiente. A
hemodiálise intermitente é indicada em casos de aumento da azotemia,
anormalidades eletrolíticas ou acidose que não respondem a ao gerenciamento da
terapia. A hemodiálise intermitente também é indicada em casos de oligúria e anúria.
Antes de considerar a hemodiálise intermitente
considere as questões em seu paciente:
-
Reidratei
adequadamente meu paciente?
-
Corrigi a
hipovolemia e a hipotensão usando fluidoterapia ou medicamentos?
-
Desafiei meu
paciente anúrico ou oligúrico com terapia diurética?
Se as respostas forem sim a essas perguntas e o
tratamento médico não melhorou o quadro clinico e clinicopatológico do
paciente, ou se o risco de vida a gravidade da doença impede a atenção a cada
questão, a consideração a hemodiálise inermitente é garantida. Essas questões
devem ser abordadas em questão de horas, não dias, porque a intervenção precose
meçhora a chance de um resultado bem-sucedido.
Intervenção
dialítica para intoxicação
A hemodiálise é uma opção eficaz para
remoção extracorpórea de toxinas endógenas e exógenas quando suas
propriedades farmacocinéticas são compatíveis com a depuração
pela membrana do dialisador. A hemodiálise pode prevenir disfunção orgânica ou
morte quando iniciada imediatamente após intoxicações pela depuração de toxinas
antes que elas se distribuam completamente pelo corpo ou encurtando seu tempo
de exposição. Uma revisão extensa do momento da terapia, prescrição para
remoção eficaz de toxinas e limitação da hemodiálise na remoção de toxinas foi
publicada em outro lugar e excede o escopo deste manuscrito.
Declaração:
A hemodiálise é indicada para remoção de toxinas quando não há antídoto eficaz
ou uma modalidade terapêutica
potencialmente mais eficaz (por
exemplo, hemoperfusão ou troca plasmática terapêutica) e
a(s) concentração(ões) de toxinas ou concentração(ões) suspeita(s) é(são)
suficiente(eis) para causar morbidade, risco de vida ou dano tecidual .
A eficácia da hemodiálise depende de características específicas da toxina que
permitiriam a remoção eficaz, especificamente seu peso molecular, ligação de
proteína e
volume de distribuição. A IHD de alta eficiência é mais eficaz se o peso
molecular do tóxico for menor que 15.000 Da, o grau de ligação de proteína for
<80% e o volume de distribuição (Vd) for <2 L/kg. Considerações adicionais que
impactam a remoção incluem a meia-vida da toxina e o potencial de rebote
(concordância de 100%).
Momento do início da
diálise em animais com doença renal crônica
Declaração:
A hemodiálise crônica é realizada raramente em animais, mas pode ser
considerada em animais com doença renal crônica (DRC)
IRIS Estádio 4 quando os sinais clínicos (por exemplo, perda de peso,
inapetência, vômito) e anormalidades clinicopatológicas (por exemplo, distúrbios ácido-básicos,
eletrolíticos , hiperfosfatemia) não podem ser controlados efetivamente, apesar
do tratamento médico abrangente e adequado (incluindo o uso de uma sonda de
alimentação). A intervenção deve ser considerada quando todos os outros meios
não forem suficientes, no entanto, antes que os animais tenham descompensado
substancialmente (por exemplo, tenham ficado emaciados) e tenham menos
probabilidade de se beneficiar da intervenção (92% de concordância).
Seleção de plataforma
As
modalidades mais comuns para hemodiálise em animais com LRA são CRRT ou
IHD. A CRRT é administrada em uma plataforma de tratamento CRRT (máquina) e
projetada para uma administração contínua gradual de tratamento ao longo de
dias. Normalmente é menos eficiente e potencialmente mais custosa em comparação
com a IHD. A hemodiálise intermitente é administrada em uma plataforma de
tratamento IHD (máquina), projetada para tratamentos descontínuos relativamente
curtos (4–5 horas), mas intensos. Embora cada uma dessas plataformas tenha sido
projetada para administrar um tipo de tratamento específico, mas aparentemente
oposto, uma hemodiálise prolongada simulando um tratamento contínuo pode ser
administrada usando uma plataforma intermitente, e um tratamento intermitente e
um tratamento relativamente intenso podem ser realizados em animais usando uma
plataforma CRRT. Os objetivos do tratamento e a prescrição do tratamento
definem o tipo de tratamento em vez da plataforma usada para administrar o
tratamento. Quando qualquer uma das plataformas é usada para seu propósito de
tratamento não intencional, cada uma pode ter limitações específicas de
tratamento. Por exemplo, os tratamentos administrados em uma plataforma CRRT
geralmente não podem fornecer um tratamento de manutenção altamente eficiente
em comparação com as plataformas intermitentes. Tratamentos de manutenção
entregues em plataformas CRRT podem ter custo proibitivo, especialmente em
animais grandes. Plataformas IHD caracteristicamente são limitadas em entregar
prescrições de baixa intensidade necessárias para tratamentos iniciais em
animais severamente urêmicos ou pequenos, devido a limitações inerentes para
entregar taxas de fluxo de sangue e dialisato apropriadas e precisão limitada
de controladores de ultrafiltração .
Declaração: É vantajoso ter flexibilidade em plataformas
de diálise que permitam tratamentos contínuos, de baixa intensidade, à beira do
leito (por exemplo, CRRT) para animais com doença crítica, bem como tratamento
de alta eficiência para animais que requerem períodos intermediários a
prolongados (semanas a meses) de terapia de substituição renal (por exemplo,
IHD) (100% de concordância)
Declaração: Qualquer plataforma pode ser usada para o
tratamento inicial, no entanto, em animais maiores (ou seja, >20 kg), a hemodiálise de manutenção é
realizada de forma mais eficaz, prática e econômica com uma plataforma IHD
(100% de concordância)
Declaração: A IHD deve ser considerada como tendo
eficiência superior para remoção de toxinas em comparação à terapia contínua
(92% de concordância).
As principais forças usadas durante a IHD são
difusão, convecção e adsorção. A magnitude da troca de fluidos e solutos é
determinada pelas características do soluto, bem como o tamanho dos poros e as
características estruturais da membrana do dialisador. Na hemodiálise
intermitente, a difusão é a força mais prevalente para a troca de solutos
e fluidos; convecção e adsorção geralmente desempenham um papel menor. Durante
a difusão, os solutos se movem de áreas de alta para baixa concentração. Os
solutos deixam o sangue ou o compartimento do líquido dialisante no qual foram
dissolvidos, atravessa a membrana de diálise e entra no compartimento oposto de
fluido. Os solutos sanguíneos, como BUN, creatinina e eletrólitos, difundem-se
através da membrana semipermeável do dialisador e é descartado pelo dialisato.
Solutos em alta concentração no dialisato, como bicarbonato e eletrólitos
selecionados podem difundir na membrana do dialisador de acordo com seu
gradiente de concentração no sangue. A taxa de transferência de soluto por
difusão é determinada pelo gradiente de concentração do soluto, energia
cinética (determinada pelo peso molecular) e permeabilidade da membrana. A
difusão é melhor na remoção de moléculas com baixo peso molecular no sangue
como ureia, creatinina, sódio, potássio e magnésio.
Durante a convecção, a água é removida do snague
junto com os solutos dissolvidos. O sangue que viaja nas membrans
semipermeáveis do silaisador é exposto a pressão transmembrana que empurra
fluido (ultrafiltrado) e solutos dissolvidos para fora do sangue, através da
membrana do dialisador e no dialisato, que é descartado. A taxa de
transferência de fluido e solvente via convecção é determinada porpressão
hidrostática transmembrana entre o sangue e o dialisato e a área da superfície
da membrana de diálise. A convecção, uma força predominante em terapia de
substituição renal, mas não em hemodiálise intermitente, é melhor em removendo
moléculas de baixo e médio peso molecular do sangue.
Priming de volume e
proming de fluidos
O
volume de priming do circuito extracorpóreo é determinado pelos volumes de
sangue coletivos do hemodialisador, pela tubulação de entrada e retorno e,
ocasionalmente, por componentes adicionais incorporados ao circuito
extracorpóreo (por exemplo, câmara de monitoramento de volume em linha,
dispositivos de hemoperfusão). O
volume do circuito extracorpóreo em relação ao volume de sangue do animal é uma
consideração importante para a prescrição e administração de hemodiálise,
especialmente em animais muito pequenos. Portanto, é importante
avaliar os parâmetros de perfusão do animal antes do tratamento, bem como
calcular a porcentagem do volume do circuito extracorpóreo em relação ao volume
sanguíneo do animal.
O início da hemodiálise não promove
nenhuma alteração imediata no volume intravascular, pois o volume de sangue
aspirado do animal é igual ao volume de fluido de preparação retornado ao
animal do circuito extracorpóreo. No entanto, dependendo da composição do
fluido usado para preparar o circuito extracorpóreo, o volume e a composição
intravascular podem ser substancialmente e clinicamente significativamente
alterados. Fluidos de priming cristaloides não têm pressão oncótica , portanto o volume intravascular
diminui após o início da hemodiálise. Essas mudanças de fluido aumentam o risco
de volume intravascular prejudicado, perfusão sistêmica e promovem hipotensão.
A consequente hemodiluição e a diminuição da capacidade de
transporte de oxigênio podem comprometer o fornecimento periférico de oxigênio
se o volume de priming for grande em comparação ao volume sanguíneo. A
diminuição do volume sanguíneo após um priming cristalode é agravada ainda mais
quando a ultrafiltração é prescrita. Em animais pequenos, anêmicos e
considerados de alto risco para hipotensão, a solução de priming deve conter
componentes adicionais para aumentar a pressão oncótica coloidal (por exemplo,
plasma, coloides sintéticos) e a capacidade de transporte de oxigênio (por
exemplo, hemácias). A decisão de usar coloides sintéticos deve considerar seu
risco potencial de lesão tubular adicional em pacientes com LRA em comparação à
necessidade de prevenir hipovolemia e hipotensão. Em alguns animais,
o priming do circuito extracorpóreo com sangue total ou concentrado de
hemácias também deve ser considerado.
Declaração: O circuito extracorpóreo
idealmente deve ser <10% do volume sanguíneo (VB) do animal, mas
realisticamente, essa meta de circuito pode não ser alcançada em todas as
aplicações veterinárias. Para cães pequenos (<10 kg)
e gatos , o menor circuito extracorpóreo
disponível deve ser usado. Se o circuito exceder 15% do volume sanguíneo do
animal, deve-se considerar a composição da solução de priming para evitar hipovolemia , hipotensão e hipoxemia . Se o circuito extracorpóreo exceder
20% do VB, há um risco previsível de hipovolemia, hipotensão e hipoxemia; portanto, a solução de priming deve fornecer
suporte coloidal
e hemodinâmico eficaz e capacidade de transporte de oxigênio (por exemplo,
coloide sintético, plasma, priming de sangue total) (83% de concordância).
Declaração: O hematócrito esperado
deve ser ≥20% após a diluição do sangue com a solução de priming. Quando o
hematócrito é <20%, a transfusão de sangue antes do tratamento ou priming
sanguíneo é indicada (100% de concordância).
Dose/URR/intensidade/duração
do tratamento/esquema para pacientes veterinários com LRA
A hemodiálise
é uma modalidade eficaz para a remoção de solutos urêmicos de pequeno e médio
peso molecular. Esses solutos são removidos diretamente do compartimento
intravascular durante o tratamento; consequentemente, um gradiente de
concentração e osmótico de solutos urêmicos é criado entre a vasculatura e outros compartimentos do corpo.
Esse desequilíbrio osmótico entre os compartimentos de fluidos corporais se torna mais díspar com o
aumento da intensidade do tratamento e conforme a diálise prossegue. Os
gradientes osmóticos induzidos (desequilíbrio) promovem a mudança de fluido do
compartimento intravascular para o intersticial e, comparativamente, do
intersticial para o intracelular. Mudanças de fluido do compartimento
intravascular predispõem à hipovolemia e hipotensão, mas igualmente importante,
mudanças de fluido para dentro das células promovem a expansão do compartimento
intracelular. O excesso de fluido intracelular desloca-se para o sistema nervoso central predispondo ao edema cerebral e ao aumento da pressão intracraniana, levando a uma variedade de sinais neurológicos coletivamente denominados síndrome de
desequilíbrio de diálise (DDS). O risco de DDS aumenta com a intensidade do
tratamento de diálise e é determinado principalmente pelo tamanho do animal, o
grau de azotemia, a taxa de depuração de ureia e a presença de fatores
comorbidos, como anormalidades eletrolíticas, estado ácido-base, tendência a sangramento, hipertensão e anormalidades
neurológicas preexistentes. A síndrome de desequilíbrio de diálise pode ser
fatal e deve ser prevenida prescrevendo uma intensidade de tratamento
inversamente proporcional à gravidade da azotemia e diretamente proporcional ao
tamanho do paciente. Animais severamente
azotêmicos e animais de pequeno porte, especialmente gatos, correm maior risco
de complicações de desequilíbrio. Para animais de alto risco, uma baixa
depuração horária (K) ou taxa de redução de ureia (URR/h) deve ser prescrita, e
o tempo de tratamento deve ser estendido para atingir uma meta de tratamento
eficaz, apesar da baixa URR horária.
QUANTIFICAÇÃO DA ENTREGA DE HEMODIÁLISE
Ilustração gráfica de um
perfil BUN de 3 pontos (valores antes e depois da hemodiálise em parênteses)
que podem ser ajustados ao modelo de pool único no painel direito. Com direto
medição da depuração de ureia renal e do dialisador (Kr, consulte o Apêndice 1,
Equação 5 e Kd Apêndice 1, Equação 4, respectivamente), a modelagem cinética
permite calcular a taxa de geração de ureia (G, ver Apêndice 1, Equação 7), o
volume de distribuição de uréia (V, ver Apêndice 1, Equação 8) e a concentração
média de tempo de BUN (TACurea, consulte o Apêndice 1, Equação 3). A dose de
diálise expressa como a depuração fracional do volume de distribuição de ureia
usando a cinética de pool único (spKt/V, consulte o Apêndice 1, Equação 9)
também pode ser calculada. Td é a duração da diálise e Ti é a duração do
intervalo interdialítico. A área sob a curva (AUC) é a área sob a curva BUN
versus tempo e pode ser estimada usando um método trapezoidal ou, idealmente,
calculada ajustando as mudanças no BUN ao modelo cinético. (De Cowgill LD,
Francey T. Hemodiálise. In: DiBartola SP, editor. Fluidoterapia em pequenos
prática animal. St Louis (MO): Elsevier; 2006. pág. 650–77; com permissão.)
A taxa de redução de uréia é o preditor de
adequação universal usado para uma sessão de diálise em animais. Um animal com
BUN pre diálise baixo pode representar diálise eficaz, recuperação da função
renal (aumento da depuração renal residual), nutrição inadequada (baixa taxa de
geração de ureia ou taxa catabólica de proteinas ou sobrecarga de volume
(volume de distribuição de ireia expandida. Por outro lado, sob diálise, piora
da função renal, alta taxa catabólica ou contração de volume podem ser
refletidas por um BUN pre diálise mais alto.
A dose de
diálise entregue aos pacientes pode ser definida alternativamente pela
quantidade de depuração (remoção de soluto) fornecida pelo hemodialisador
durante a sessão de diálise. Usando a depuração instantânea do dialisador para
uréia (Kd, mL/min) e a diálise duração da sessão (t, minutos), a dose de
diálise pode ser definida como Kd x t, que prevê o volume do paciente sem ureia
durante o tratamento (mL). O valor para o volume depurado pode ser indexado
ainda mais ao reservatório total ou volume de distribuição de ureia em
pacientes (V, mL) para comparar a eficácia do tratamento entre pacientes de
diferentes tamanhos corporais como V é igual à água corporal total dos
pacientes. Esta expressão de diálise A dose é análoga à dosagem convencional de
drogas em mg/kg de peso corporal. O valor que obtido com esta expressão
cinética, Kt/V, é sem unidade e representa a depuração fracional do volume de
distribuição de ureia
A determinação
da intensidade do tratamento dialítico deve ser previamente determinada pela
taxa de redução da ureia (Urea Reduction Rate – URR), que é uma orientação para
adequação do tratamento, e é obtida em tempo real, calculada pela seguinte
fórmula:
URR = ((ureia sérica pre-hemodiálise- ureia sérica
pós-hemodiálise)/ ureia sérica pre-hemodiálise) x100
Toda a terapia
para animal urêmico (aqueles em que a diálise está sendo realizada para fins de
remoção de toxinas urêmicas) está embasada na determinação prévia da URR, e
consequentemente nas determinações das prescrições de diálise. Exceder as limitações
da URR diária nos primeiros tratamento aumenta o risco de ocorrência da
síndrome do desequilíbrio que é a consequência da rápida redução das
concentrações séricas de ureia, afetando subitamente a condição hiperosmolar
plasmática causada por essa substância, visto que, em paciente urêmicos, o
volume de distribuição da ureia nos tecidos é alto e sua rápida redução
plasmática acarreta desequilíbrio osmótico entre o plasma e o interstício, pois
a ureia intersticial não se movimenta rapidamente para o plasma, acarretando,
deslocamento de fluidos plasmáticos para o interstício (inclusive cerebral).
O risco de DDS é considerado maior
durante os primeiros tratamentos em comparação com os tratamentos subsequentes,
portanto, tratamentos mais intensivos são permitidos para graus semelhantes de
azotemia para o 2º e 3º tratamentos em comparação com o primeiro tratamento. À
medida que as complicações simultâneas são controladas a tempo, o risco
de complicações neurológicas diminui, e uma URR/h mais alta
tem menos probabilidade de resultar em complicação neurológica.
Declaração: Azotemia, distúrbios
eletrolíticos e controle de volume devem ser normalizados dentro de 24–72 h. Para tratamentos IHD eficazes e seguros, o resultado
da taxa de redução de ureia (URR) para o tratamento deve ser >35%, e o tempo
de tratamento não deve ser inferior a 180 minutos e de duração suficiente para
atingir as metas de tratamento URR recomendadas (abaixo). Se o animal tiver
<10 kg ou o BUN estiver na extremidade superior
da faixa de BUN pré-diálise, considere usar a faixa inferior da recomendação
URR/h para cada categoria de tratamento. Para prescrever a intensidade do
tratamento, o termo URR/h representa a mudança horária projetada linear em BUN
ao longo do intervalo de resultado URR prescrito para a sessão de tratamento
(URR total [%] ÷ tempo de tratamento [h]). A redução real de ureia por hora
excederá variavelmente a URR/h prescrita devido à mudança exponencial na
característica BUN dos tratamentos IHD (concordância de 83%).
Uma vez definida a taxa de redução de ureia
(URR), devem ser calculados a taxa de fluxo de sangue (Qb), a taxa de fluxo
da solução dialisante (Qd), o clearance do hemodialisador (Kd), a taxa de
ultrafiltração (UFF) e o tempo de diálise (Td), de modo a adequar a
prescrição ao tamanho e necessidades do animal.
A relação
entre URR e o volume de sangue a ser processado deve ser consultado para
minimizar o risco de síndrome do desequilíbrio nos primeiros tratamentos, e no
final verifica-se se os objetivos forma alcançados, considerando ainda o status
de estabilidade do paciente.
Declaração: 1º tratamento:
Recomenda-se uma meta de URR de tratamento de pelo menos 35%.
|
Primeiro tratamento antigo |
|
|
||
|
Ureia |
URR @ URR/h |
tempo/hora URR/URR/h |
||
|
< |
428 |
<0,5 @ >0,1 URR/h |
5 |
|
|
428 |
642 |
0,5
a 0,3 @ >0,1 URR/h |
5 |
3 |
|
> |
642 |
0,4 @ >0,05 a 0,07 URR/h |
8 |
5,7 |
|
Primeiro tratamento Atualizado pelas
diretrizes de 2024 |
|
|
||
|
Ureia |
URR @ URR/h |
tempo/hora URR/URR/h |
||
|
< |
214 |
0,35 @0,1 a 0,15 URR/h |
3,5 |
2,3 |
|
214 |
428 |
0,35 @0,75 a 0,1 URR/h |
4,7 |
3,5 |
|
428 |
642 |
0,35 @0,05 a 0,7,5 URR/h |
7,0 |
4,7 |
|
> |
642 |
0,35 @<0,05 URR/h |
7,0 |
|
(100% de concordância)
Declaração: 2º tratamento:
Recomenda-se uma meta de URR de tratamento de pelo menos 40%.
|
Segundo tratamento |
|
|
|
|
||
|
Ureia |
|
URR @ URR/h |
tempo/hora URR/URR/h |
|||
|
< |
428 |
0,6 a 0,7 @ 0,12 a 0,15 URR/h |
5 |
4 |
5,8 |
4,7 |
|
428 |
642 |
0,6 a 0,4 @não > 0,05 a 0,1 URR/h |
12 |
6 |
8 |
4 |
|
> |
642 |
0,4 @não > 0,05 a 0,1 URR/h |
8 |
4 |
|
|
|
Segundo tratamento Atualizado pelas
diretrizes de 2024 |
|
|
|
|
||
|
Ureia |
URR @ URR/h |
tempo/hora URR/URR/h |
||||
|
< |
214 |
0,4 @ 0,1 a 0,2 URR/h |
4 |
2 |
|
|
|
214 |
428 |
0,4 @ 0,1 a 0,12 URR/h |
4 |
3,3 |
|
|
|
428 |
642 |
0,4 @ 0,05 a 0,1 URR/h |
8 |
3,3 |
|
|
|
> |
642 |
0,4 @ <0,05 URR/h |
8 |
|
|
|
(100% de concordância)
Declaração: 3º e tratamentos
subsequentes: A meta do tratamento deve estabelecer um BUN pós-tratamento que
se aproxime ou esteja dentro do intervalo de referência.
|
Terceiro tratamento |
|
|
|
|
||
|
Ureia |
URR @ URR/h |
tempo/hora URR/URR/h |
||||
|
< |
321 |
> 0,8 @ >0,15 URR/h |
5,3 |
|
||
|
321 |
642 |
0,5 a 0,6 @0,15 a 0,1 URR/h |
3,3 |
5 |
4 |
6 |
|
> |
642 |
0,5 a 0,6 @ <0,1 URR/h |
5 |
6 |
|
|
|
Terceiro tratamento Atualizado pelas
diretrizes de 2024 |
|
|
|
|
||
|
Ureia |
URR @ URR/h |
tempo/hora URR/URR/h |
||||
|
< |
214 |
@ 0,2 a 0,25 URR/h |
|
|||
|
214 |
321 |
@ 0,1 a 0,15 URR/h e e/ou o animal
tiver <10 kg para atingir um BUN de 40 mg/dL |
4 |
2,7 |
2,7 |
1,8 |
|
A meta do tratamento deve estabelecer
um BUN pós-tratamento que se aproxime ou esteja dentro do intervalo de referência |
||||||
(92% de concordância)
Avaliação
de adequação
Não há dados de resultados
veterinários avaliando a adequação do tratamento em animais com LRA tratados
por hemodiálise. A adequação do
tratamento pode ser avaliada pela URR geral, no entanto, essa medida avalia a
adequação do tratamento de forma incompleta e pode ser enganosa, pois não
fornece uma avaliação da depuração global de solutos urêmicos de todos os
compartimentos corporais. A medida mais comumente usada de adequação da diálise em pacientes humanos é a
depuração fracionada de ureia do paciente, Kt/V ureia. Este
termo descreve a depuração de ureia fornecida ao paciente normalizada para o
volume de distribuição de ureia do paciente. O Kt/V ureia pode
ser calculado medindo a depuração do dialisador e estimando o volume de
distribuição do paciente. Muitas máquinas IHD modernas são equipadas com
dialisância iônica para estimar o Kt/V. Esta tecnologia é baseada em mudanças
na condutividade do dialisato na entrada e na saída do hemodialisador. Ao calcular Kt/V, o estado de hidratação deve
ser levado em consideração e o volume de distribuição deve ser estimado
apropriadamente.
Declaração: Diretrizes para tratamento
de manutenção: os resultados da URR para tratamentos de manutenção devem ser de
pelo menos 80%, com duração mínima de 240 min e Kt/Vureia mínimo de ≥1,6. (92% de concordância)
Declaração: O volume de distribuição
de ureia (V) deve ser calculado com base na estimativa clínica de hidratação de
acordo com o seguinte: BW*(fator de hidratação). O volume de distribuições deve
ser corrigido com base na hidratação da seguinte forma:
-5% → 0,58
Euhidratado → 0,6
+5% → 0,62
+10 → 0,64
+15 → 0,65
+20 → 0,67
(83% de concordância)
A dose de diálise entregue aos pacientes pode
ser definida alternativamente pela quantidade de depuração (remoção de soluto)
fornecida pelo hemodialisador durante a sessão de diálise. Usando a depuração
instantânea do dialisador para uréia (Kd, mL/min) e a diálise duração da sessão
(t, minutos), a dose de diálise pode ser definida como Kd x t, que prevê o
volume do paciente sem ureia durante o tratamento (mL). O valor para o volume
depurado pode ser indexado ainda mais ao reservatório total ou volume de distribuição
de ureia em pacientes (V, mL) para comparar a eficácia do tratamento entre
pacientes de diferentes tamanhos corporais como V é igual à água corporal total
dos pacientes. Esta expressão de diálise A dose é análoga à dosagem
convencional de drogas em mg/kg de peso corporal. O valor que obtido com esta
expressão cinética, Kt/V, é sem unidade e representa a depuração fracional do
volume de distribuição de ureia.
Ex: Canino, fêmea, 8 meses, 9,5 kg, LRA (ureia 481 mg/dL, creatinina
17,54 mg/dL, fósforo 9,3 mg/dL). Normohidratada.
a) Qual a % máxima de VST
desse anomal que poderá permanecer no circuito extracorpóreo?
R: Peso x %sangue corpo = 9,5 x 0,8 = VST 760 mL, somente 10% pode ficar
no circuito externo, então 76 mL.
Linha menor é preenchida com 59
mL o FX4 com 42 mL, totalizando 101 mL
Tem que trocar pelo Fx PAED (18 mL), então 59 mL+18 mL = 77 mL é
aceitável
b) De acordo com a URR
escolhida, qual será o tempo da primeira sessão deste animal?
R: Nas diretrizes anteriores, de 3 a 5 horas
|
428 ureia |
642 ureia |
0,5 a 0,3 @ >0,1 URR/h |
5 |
3 |
Mas na desse guideline, de 4,67 a
7 horas
|
428 ureia |
642 ureia |
0,35 @0,05 a 0,7,5 URR/h |
7 |
4,67 |
c)
Qual será o fluxo de sangue (mL/min) desse paciente segundo
a URR.
R: Peso x URR (que no anterior
escolhi o tempo menor e na diretriz atual escolhi tb o tempo menor de 3
a 4,67 horas
Então 9,5 x3 *100= 2.850mL que
dividido por 3 e por 60 = Qb15,83 mL/min
Ou 9,5 x 4,67 =4.437 mL que
dividido por 4,67 e por 60 = Qb 15,83 mL/min
OBS: fluxo menor que 50 mL/minuto
é muito baixo e não oferece segurança
d)
Qual será o fluxo de sangue (mL/min) deste paciente
segundo o Kt/V?
R: 1º. Volume de ureia do
paciente pela valor da hidratação, que nesse caso é normohidratado = Peso x
formula acima = 9,5 x 0,6= 5,7 L
2º. Escolher o tempo (3 ou 4,67
h)
Kt/V = -ln(1-0,4) para 4 horas de
URR=0,51x volume de ureia (5,7)=2.850L
Dividido pelo tempo de URR 4 =
712,5 Qb= 11,86 mL/min
Kt/V = -ln(1-0,3) para 3 horas de
URR=0,3566 x volume de ureia (5,7)=1995L
Dividido pelo tempo de URR 3 =
665 Qb= 11,08 mL/min
BY
PASS
Linha menor é preenchida com 59
mL o FXPaed com 18 mL e cabe de
dialisato 60 mL
Então o tanto de dialisato 60 x 3
= 180 mL ou 60 x4 = 240 mL
VST:760mlx3=2280 ou em 4 horas
3040L ambos serão 760 mL/h
760mL/h- 180=580 dividido por 3
momentos = 193,33 mL
193,33 dividido pelo QB de
60 = 3,22 ou seja 3,2 minutos com QB60 e
16,8 pausado. Isso a cada 20 minutos.
By Pass e kt/v devem ser melhor explorado para melhor compreensão!
Declaração: Uma vez que as alterações
no volume e composição do fluido corporal tenham sido normalizadas, o
esquema de tratamento deve ser mantido de forma otimizada em um esquema de três vezes por semana até que a diálise não
seja mais necessária. Raramente, são necessários tratamentos de mais de
três vezes por semana (estado altamente catabólico, hiperidratação grave,
hipercalemia grave). Em animais com função renal residual suficiente, um
esquema de duas vezes por semana pode ser adequado. Um esquema de duas vezes
por semana pode ser ditado em algumas circunstâncias por considerações
logísticas.
Declaração: Não há justificativa
cinética para um esquema de menos de duas vezes por semana (92% de
concordância).
Hemodialisadores
Propriedades como área de superfície,
tamanho médio de poro e espessura de membrana contribuem para o desempenho de
uma membrana hemodialisadora. O desempenho in vitro de hemodialisadores pode ser
classificado, quantificado e comparado pelo coeficiente de área de transferência
de massa (KoA) e pelo coeficiente de ultrafiltração (Kuf). À medida que esses
coeficientes aumentam, o dialisador é capaz de maior depuração de soluto e
remoção convectiva de água, respectivamente. Essas propriedades, juntamente com
o material da membrana e o volume de preparação, são usadas para selecionar o
hemodialisador para atingir os objetivos do tratamento de forma mais adequada e
segura. Os hemodialisadores de baixa eficiência têm a menor área de superfície
(por exemplo, 0,3 m 2 ) e volume de preparação e
geralmente têm um KoA baixo. No entanto, para animais pequenos, sua eficiência
geralmente excede a necessária para fornecer um tratamento inicial eficaz,
embora menos intensivo, para animais urêmicos. Os dialisadores de alta
eficiência são usados comumente em cães de raças médias e grandes para fornecer
tratamentos muito eficientes, geralmente produzindo resultados de URR > 90%
e Kt/V ureia > 2,5 durante um tratamento de 4 a 5
horas. A seleção de hemodialisadores com pequenas áreas de superfície é usada
para criar volumes menores de circuito extracorpóreo. O menor volume
extracorpóreo reduz os requisitos para anticoagulação sistêmica devido ao tempo de
trânsito reduzido através do hemodialisador em baixas taxas de fluxo sanguíneo.
Essa abordagem ajuda a prevenir a heparinização excessiva, o resfriamento
excessivo do sangue e melhora a estabilidade hemodinâmica durante o tratamento.
Hemodialisadores com classificações Kuf mais altas devem ser selecionados
quando requisitos de ultrafiltração elevados são prescritos.
Declaração: Os hemodialisadores devem
ser considerados descartáveis e de uso único. O reprocessamento de
hemodialisadores não é recomendado devido ao risco aumentado de
coagulação, colonização bacteriana, toxicidade do esterilizante e
segurança para o pessoal de diálise (100% de concordância).
Declaração: Os hemodialisadores feitos
com membranas de polímeros sintéticos (por exemplo, polissulfona , poliéstersulfona) são
hemocompatíveis e biocompatíveis (100% de concordância).
Declaração: Um dialisador deve ser
escolhido para atender às necessidades específicas da prescrição de
hemodiálise, incluindo meta de depuração, necessidade de ultrafiltração, volume
do circuito em relação ao volume de sangue do animal e risco de coagulação. Os
requisitos do hemodialisador podem ser diferentes para cada paciente e cada
tratamento e devem ser selecionados para atender às metas individuais do
tratamento. (100% de concordância)
Declaração: Dialisadores de alta
eficiência e alto fluxo são preferidos para maximizar a depuração de toxinas urêmicas e facilitar a remoção de solutos
de peso molecular médio, respectivamente, mas esses dispositivos podem exceder
as considerações de volume de pequenos animais e aumentar a transferência de
impurezas do dialisato (por exemplo, endotoxinas) devido à filtração reversa, a
menos que dialisato ultrapuro seja usado (100% de concordância).
FX Paed volume de sangue 18 mL e de
dialisado 60 mL
F4 volume de sangue 42 mL e de
dialisado 80 mL
F5 volume de sangue 63 mL
F6 volume de sangue 82 mL
Ultrafiltração
Animais com LRA encaminhados para
hemodiálise geralmente estão superidratados na apresentação. O excesso de
fluidos é prejudicial, especialmente em animais com anúria ou oligúria concomitantes. A superidratação
afeta negativamente a maioria dos órgãos do corpo e se torna fatal ao resultar
em edema pulmonar , insuficiência cardíaca congestiva e oligúria. A superidratação
frequentemente promove nefropatia congestiva. O aumento da pressão
intrarrenal diminui ainda mais a função renal e pode resultar em oligúria ou
anúria. O início da ultrafiltração para descarregar a carga excessiva de
fluidos é comumente associado ao aumento da urina, pois o edema e a pressão
intrarrenais são melhorados. Um objetivo prioritário da hemodiálise é remover o
excesso de fluidos do animal e restaurar um estado de hidratação normal.
Declaração: Qualquer componente de
risco de vida da hiperidratação (edema pulmonar, hipertensão refratária) requer
correção imediata com ultrafiltração aplicada durante o primeiro tratamento. A
hiperidratação não-fatal (edema periférico, nefropatia congestiva, ascite , edema intestinal, edema
pancreático) deve ser corrigida durante os dois a três tratamentos iniciais
(100% de concordância).
Declaração: O derrame pleural não é corrigido efetivamente
pela ultrafiltração e requer toracocentese . A toracocentese deve ser
realizada pelo menos 2 h antes da heparinização da diálise para ajudar a
prevenir complicações de sangramento (92% de concordância).
É importante reconhecer que fluido
excessivo pode estar presente nos compartimentos de fluido extra e
intracelular, enquanto fluidos são removidos por ultrafiltração somente do
compartimento intravascular. Se a taxa de recarga vascular de outros
compartimentos do corpo for mais lenta do que a taxa de ultrafiltração
prescrita, o volume sanguíneo diminuirá. Isso resulta em diminuição da perfusão tecidual e hipotensão quando a ultrafiltração
é excessiva. A taxa de ultrafiltração prescrita deve ser individualizada para
cada animal, reconhecendo que alguns animais toleram uma taxa de ultrafiltração
maior do que outros para o mesmo grau de superidratação.
Declaração: A tolerância à ultrafiltração
varia entre os animais e o grau de super-hidratação, integridade vascular
(função endotelial), função cardíaca, pressão oncótica e a intensidade da
ultrafiltração prescrita. A maioria dos cães super-hidratados tolera taxas de
UF de até 8–10 mL/kg/h, e a maioria dos gatos super-hidratados tolera
taxas de UF de até 5 mL/kg/h. Essas diretrizes devem ser usadas como alvos
iniciais máximos durante o primeiro tratamento e devem ser ajustadas durante o
tratamento de acordo com a tolerância individual (100% de concordância).
Declaração: Pequenos animais
(especialmente gatos) podem ter menor tolerância à ultrafiltração devido ao
volume extracorpóreo relativamente alto em relação ao seu volume intravascular.
Da mesma forma, deve-se ter cautela em animais normotensos e hipotensos; o
volume e o estado hemodinâmico devem ser monitorados de perto,
e a prescrição de ultrafiltração ajustada com base na intolerância do animal
(100% de concordância).
Declaração: Altas taxas de
ultrafiltração em tratamentos subsequentes (até 15–20 mL/kg/h) podem ser toleradas em animais individuais com cargas
de fluidos persistentes ou contínuas com supervisão e monitoramento rigorosos.
A ingestão de fluidos (oral e parenteral) deve ser avaliada criticamente em
animais com requisitos de ultrafiltração persistentemente altos (92% de
concordância).
Durante os tratamentos de hemodiálise a agua e o
sódio são removidos por ultrafiltração. A ultrafiltração é comumente realizada
pela redução da pressão hidrostática do compartimento do dialisador, permitindo
que a agua contendo eletrólitos e outras substâncias permeáveis se movam do
plasma para o dialisato.
Ultrafiltração
é um dos princípios utilizados nas técnicas dialíticas e se refere ao processo
de remoção de fluido. Como esse fluido é removido da corrente sanguínea, o
processo também pode ser denominado de hemofiltração, que é indicada para
pacientes com sobrecarga de volume. A taxa de ultrafiltração não deve exceder
20 mL/kg/h e a quantidade de fluido a ser removida (que pode demandar mais de
uma sessão) deve ser baseada no seguinte cálculo:
Quantidade em
mL a ser retirada= % de hiperhidratação x peso corporal em kg x 10
Monitoramento rigoroso é necessário em
todos os animais submetidos à ultrafiltração. Pequenos animais, e especialmente
gatos, são mais propensos à hipotensão durante a hemodiálise. Uma variedade de
ferramentas está disponível para avaliar e monitorar a tolerância dos animais à
ultrafiltração. Avaliação clínica, monitoramento do volume sanguíneo em linha,
pressão arterial e vários testes laboratoriais podem fornecer orientação sobre
a tolerância do animal à ultrafiltração. O monitoramento contínuo do volume
sanguíneo em linha avalia as mudanças relativas no volume sanguíneo e na saturação venosa mista de oxigênio ao longo do tratamento e é o
método mais sensível para avaliar o desempenho e a tolerância à ultrafiltração.
A taxa de mudança e a magnitude da mudança nas avaliações do volume sanguíneo
em linha preveem se a prescrição de ultrafiltração é apropriada, insuficiente
ou excede a meta de ultrafiltração e se a taxa de recarga vascular é apropriada
para a taxa de ultrafiltração fornecida. Uma queda acentuada no volume
sanguíneo sugere que a taxa de ultrafiltração é excessiva e provavelmente não
será tolerada, a menos que a taxa de ultrafiltração seja diminuída. A saturação venosa de oxigênio também é medida continuamente pelo
monitoramento em linha e reflete o débito cardíaco e a perfusão tecidual. Este
é um dos métodos mais sensíveis para identificar intolerância às taxas de
ultrafiltração prescritas. Com o monitoramento cuidadoso das alterações no
volume sanguíneo e na saturação venosa de oxigênio, juntamente com os ajustes
apropriados na taxa de ultrafiltração, a hipotensão pode ser prevenida na
maioria dos pacientes. Deve-se ter cuidado na interpretação de mudanças
negativas espontâneas e rápidas em avaliações de volume sanguíneo em linha,
pois essas observações geralmente são resultado de excitação, náusea, vômito ou
diarreia. Essas mudanças abruptas aparecem ao longo de alguns minutos e
geralmente retornam à linha de base anterior em 10–15 minutos, em contraste com
a hipovolemia, que é mais lenta para progredir e improvável de se resolver
espontaneamente.
Declaração: Animais submetidos à UF
precisam de monitoramento rigoroso devido ao risco de hipovolemia e hipotensão.
Parâmetros de exame físico, incluindo combinações de taquicardia , qualidade de pulso fraca e
extremidades frias, dão suporte à presença de volume circulante efetivo diminuído, mas esses sinais
representam manifestações tardias de hipovolemia. Uma diminuição moderada na
pressão arterial é esperada, mas deve levar à reavaliação da tolerância da taxa
de ultrafiltração. A hipotensão representa uma manifestação tardia de
hipovolemia e a pressão arterial não deve ser usada como único parâmetro para
monitorar a tolerância à ultrafiltração. Alterações em tempo real no volume
sanguíneo e na saturação venosa central de oxigênio são os marcadores mais
oportunos e sensíveis do volume circulante efetivo. O monitoramento em linha do
volume sanguíneo (como estimativa baseada em hematócrito) e da saturação venosa
de oxigênio são os padrões de tratamento em IHD veterinária (100% de
concordância).
Relação entre gradientes de PCO2
venoarterial e alterações microvasculares. Em condições normais, a maioria das
áreas é adequadamente perfundida e, portanto, oxigenada. Os requisitos
metabólicos são atendidos e não há estagnação do fluxo. A produção de CO2 é
rapidamente eliminada, e o gradiente de PCO2 venoarterial é mínimo. Em
condições sépticas, a microcirculação é heterogênea, com áreas que são mal
perfundidas em proximidade com áreas bem perfundidas. Nas áreas não
perfundidas, há aumento de CO2 devido à estagnação do fluxo e geração
anaeróbica indireta de CO2 devido ao tamponamento de H+ gerado pela hidrólise
de ATP. Curiosamente, o CO2 difunde distâncias maiores do que o O2 para que
possa atingir as vênulas de drenagem. Nas áreas bem perfundidas, o fluxo se
torna excessivo, de modo que o SO2 venoso dessa área está em excesso
contribuindo para o alto SvO2. Portanto, o lado venular da microcirculação
doente é caracterizado por uma alta SvO2,PCO2 e lactato.
O
exame físico desempenha um papel muito importante na avaliação de pacientes
gravemente enfermos. Certas características como cor da pele, enchimento
capilar, mentação, débito urinário e qualidade do pulso podem nos dizer muito
sobre o estado hemodinâmico do paciente. No entanto, algumas características
muito importantes permanecem ocultas até mesmo do observador mais experiente ou
se tornam óbvias apenas em seus extremos. São os níveis de bicarbonato e
lactato, concentrações de íons de hidrogênio (ou seja, pH) e o equilíbrio entre
fornecimento e consumo de oxigênio. Embora para monitoramento detalhado sejam necessárias
medições hemodinâmicas invasivas, elas não estão disponíveis em todos os
pacientes. No entanto, cateteres arteriais e venosos centrais são parte do
monitoramento de rotina do paciente de terapia intensiva, e uma simples medição
de gases no sangue pode revelar processos fisiológicos importantes, que não
podem ser detectados de outra forma.
Composição
do dialisato
A composição do dialisato é
responsável por alterações da composição sanguínea durante o tratamento e,
portanto, é um componente importante da prescrição de diálise. Na maioria das
plataformas IHD, a concentração prescrita de alguns solutos (por exemplo,
bicarbonato, sódio) pode ser configurada diretamente pela máquina, enquanto a
composição de outros solutos requer seleção de concentrados ácidos com
formulações específicas de soluto.
Ao prescrever a composição do
dialisato, as anormalidades presentes no sangue do animal antes do início da
diálise e as metas de composição plasmática para o tratamento devem ser levadas
em consideração para prever a composição apropriada do dialisato. Por exemplo,
em animais severamente urêmicos e hipernatrêmicos, a diminuição na
concentração de sódio pode contribuir ainda mais para a diminuição da
osmolalidade extracelular, predispondo o risco de DDS. Essa preocupação também
é uma consideração para animais hiperglicêmicos. Em animais severamente
urêmicos com alto risco de DDS, a concentração de sódio do dialisato pode ser
perfilada ou modelada para mudar de menor para maior durante o tratamento para
amortecer a diminuição na osmolalidade extracelular resultante da diminuição na
concentração de ureia durante o tratamento, diminuindo assim o risco de DDS.
Sódio
Alterações nas concentrações de soluto
desordenadas associadas à uremia podem não ser dissociadas facilmente das
alterações na concentração de ureia durante o tratamento de diálise. Por
exemplo, animais com azotemia grave e hipercalemia podem exigir prescrição de uma
taxa de depuração para ureia para diminuir a concentração de ureia gradualmente
e com segurança; no entanto, a baixa taxa de depuração de ureia também se
aplicará à depuração de potássio, resultando em uma correção mais lenta na
concentração de potássio do que o desejado. Nesses casos, a concentração de
potássio do dialisato deve ser reduzida para aumentar o gradiente entre as
concentrações de potássio no sangue e no dialisato, aumentando a força motriz
para a difusão do potássio, e um tratamento mais longo deve ser prescrito para
atingir ambos os objetivos terapêuticos.
Declaração: A concentração de sódio do
dialisato é prescrita com base na consideração da concentração de sódio
pré-tratamento do animal e da concentração de sódio alvo final. Para a maioria
dos animais, a concentração de sódio no final do tratamento deve ser
direcionada para a faixa de referência. Para aumentar a concentração de sódio
pré-tratamento de um animal para uma meta mais alta, a concentração de sódio do
dialisato deve ser prescrita para aproximadamente 8 mmol/L acima da meta final da diálise. Em geral, a
concentração de sódio do dialisato não deve promover sobrecarga do animal com
sódio (75% de concordância).
Potássio
Declaração: Em animais normocalêmicos
ou hipocalêmicos, a concentração de potássio do dialisato deve ser prescrita
para ser próxima à fisiológica (ou seja, 3–4 mEq/L) (3–4 mmol/L) para evitar a depleção de potássio do animal. Em
animais com hipercalemia grave, uma concentração menor de potássio do dialisato
(0–2 mEq/L) (0–2 mmol/L)
maximizará a depuração de potássio (92% de concordância).
Bicarbonato
A maioria dos animais com LRA grave
apresenta acidose metabólica que pode ser corrigida com hemodiálise,
prescrevendo uma concentração maior de bicarbonato no dialisato em comparação à
concentração de bicarbonato no sangue. Isso facilitará a difusão do bicarbonato
do dialisato para o sangue, promovendo carga líquida de bicarbonato para o
animal para corrigir a acidose metabólica.
Declaração: Em animais com acidose metabólica, a concentração de bicarbonato no
dialisato geralmente é definida como uma concentração maior do que o normal
para promover a carga de bicarbonato do animal. A normalização do bicarbonato
sérico é lenta devido à geração contínua de ácido, volume de distribuição de
bicarbonato e tamponamento de cargas de ácido existentes durante o tratamento.
Para o primeiro tratamento (geralmente de baixa intensidade) de um animal
acidêmico, a concentração de bicarbonato é tipicamente definida em 30–35 mEq/L
(30–35 mmol/L). Em tratamentos subsequentes, a concentração de
bicarbonato é prescrita com base no grau de acidose metabólica, tipicamente em uma faixa entre 26 e
32 mEq/L (26–32 mmol/L). Alta concentração de bicarbonato pode levar a
respiração ofegante implacável e acidose paradoxal do SNC. A respiração
ofegante na ausência de outras causas óbvias (por
exemplo, dor, hipertermia) pode prever a necessidade de reduzir a concentração
de bicarbonato no dialisato em 3–5 mEq/L (3–5 mmol/L). A presença de outros
distúrbios ácido-básicos (acidose ou alcalose respiratória) deve ser levada em
consideração ao prescrever concentração de bicarbonato (92% de concordância).
Cálcio
A concentração de todos os solutos
pequenos o suficiente para atravessar a membrana de diálise semipermeável deve
ser considerada na formulação do dialisado. O cálcio é tipicamente incluído na
maioria dos concentrados ácidos para prevenir a hipocalcemia . Uma exceção seria quando a
anticoagulação regional com citrato é usada.
Declaração:
O cálcio ionizado é facilmente removido pela diálise, e uma concentração
fisiológica de cálcio deve estar presente no dialisato (tipicamente 2–3 mEq/L)
(1–1,5 mmol/L)
para evitar a criação de hipocalcemia sintomática
. Se a anticoagulação regional com citrato (RCA) estiver sendo usada, o
dialisato deve ser livre de cálcio, e o animal precisará de uma infusão
intravenosa de cálcio para prevenir a hipocalcemia (92% de concordância).
Fosfato
A
hiperfosfatemia é comum em animais com LRA, portanto, a maioria dos
concentrados ácidos não contém fósforo. Quando a diálise é continuada por mais
do que alguns tratamentos, ou uma alta dose de diálise é prescrita na tentativa
de facilitar a remoção de toxinas urêmicas ou toxinas exógenas, deve-se
considerar a prevenção da hipofosfatemia no
final do tratamento. Isso é especialmente relevante para a descontaminação
dialítica de animais não azotêmicos após intoxicação por etilenoglicol,
quando um tratamento de hemodiálise intenso é indicado, mas o fosfato sérico
provavelmente está normal (veja abaixo).
Declaração:
As formulações de dialisato padrão não contêm fosfato, o que é apropriado para
os 1–3 tratamentos iniciais em animais com LRA quando a hiperfosfatemia está
presente. Durante os tratamentos de diálise subsequentes, a concentração de
fosfato do dialisato é definida entre 0 - 2 mg/dL (0–0,65 mmol/L),
dependendo do grau de hiperfosfatemia antes
do início do tratamento. A concentração de fosfato do dialisato pode ser
aumentada para 2 mg/dL (0,65 mmol/L) no início ou durante o
tratamento, dependendo da concentração de fosfato pré-tratamento e da
intensidade do tratamento para evitar reduções na concentração sérica de
fosfato para <2 mg/dL
(0,65 mmol/L)
(92% de concordância).
Aditivos
Em
circunstâncias selecionadas, substâncias são adicionadas ao dialisato para
facilitar considerações específicas do tratamento. Um dos exemplos mais comuns
é a adição de etanol e fósforo no manejo dialítico da intoxicação por etilenoglicol.
Animais que apresentam intoxicação por etilenoglicol antes do desenvolvimento
de LRA são tratados adequadamente com hemodiálise para descontaminar o animal
do etilenoglicol e seus metabólitos em uma tentativa de prevenir os efeitos
deletérios dessa toxina. Como esses animais são tipicamente normofosfatêmicos e
os concentrados ácidos não contêm fósforo, o tratamento de diálise de alta
intensidade necessário (para remover o etilenoglicol e seus metabólitos)
resultará em hipofosfatemia. Adicionar fósforo ao concentrado de diálise
previne essa complicação potencial. O etanol também é adicionado ao concentrado
ácido para atingir uma concentração sanguínea terapêutica para competir com o
etilenoglicol pela conversão em seus metabólitos tóxicos via álcool desidrogenase.
A
adição de solutos ao dialisado requer cálculo cuidadoso da quantidade de
aditivo misturado com o componente ácido, levando em consideração a diluição do
concentrado ácido pela máquina. A proporção do concentrado ácido difere entre
os fabricantes de máquinas e deve-se ter cautela antes de usar protocolos
preexistentes que podem ser formulados para uma máquina, mas inapropriados para
outras máquinas.
Declaração:
Deve-se determinar cuidadosamente a quantidade de aditivo a ser adicionada aos
concentrados de dialisato ou ao dialisato a granel com base em um cálculo do
fator de diluição para sistemas com geração de dialisato on-line ou o volume de
fluido de dialisato pré-formado em uma plataforma CRRT ou plataformas IHD com
geração centralizada de dialisato. (100% de concordância)
Declaração:
A suplementação de fosfato de dialisato é indicada em tratamentos de alta
intensidade quando o fosfato sérico é normal no início do tratamento (por
exemplo, intoxicações, diálise de manutenção) para atingir uma concentração
final de dialisato de aproximadamente 4 mg/dL (1,29 mmol/L). (100% de concordância).
Declaração:
Ao tratar intoxicação aguda por etilenoglicol, etanol (inibidor competitivo do
metabolismo do etilenoglicol) deve ser adicionado ao dialisado para atingir uma
concentração final de 0,1% (1 mL a cada 1
L de solução ácida). Isso fornece um mecanismo eficiente e eficaz para
administrar etanol para manter uma concentração sanguínea relativamente constante
durante o tratamento (100% de concordância).
Temperatura do
dialisado
A
temperatura do dialisato altera a temperatura do sangue do animal, dependendo
da diferença entre as temperaturas do dialisato e do sangue e as taxas de fluxo
do sangue e do dialisato. Na maioria dos casos, a temperatura do dialisato é
ajustada para normalizar ou manter a temperatura corporal. No entanto, as
máquinas de diálise projetadas para uso humano podem não fornecer uma
configuração de temperatura do dialisato apropriada para animais.
Ocasionalmente, a temperatura do dialisato é reduzida para promover vasoconstrição para
tratar hipotensão refratária.
Declaração:
A temperatura do dialisato é definida para normalizar ou manter a temperatura
corporal. Em um tratamento de rotina, a temperatura é definida em 37,5 °C-38,5
°C (99,5–101,3 °F). Temperaturas mais altas podem ser
usadas para animais hipotérmicos até uma temperatura máxima do dialisato de
39,5 °C (103,1 °F). Quaisquer dispositivos auxiliares
usados para modificar a temperatura do dialisato ou do sangue devem ser
calibrados para garantir a operação dentro dessas faixas de temperatura
seguras. A temperatura mais alta do dialisato predispõe à hemólise e ao
desconforto. A redução da temperatura do dialisato para 1–1,5 °C abaixo da
temperatura padrão pode promover vasoconstrição periférica
para melhorar a pressão arterial em animais hipotensos (83% de concordância).
Purificação de água e
dialisado ultrapuro
A
água é o maior componente do dialisato e a substância mais abundante exposta ao
animal tratado com diálise. Com uma taxa
de fluxo de dialisato de 500 mL/min para um animal que recebe diálise três
vezes por semana com cada sessão durando 5 h, o animal é exposto a 450 L de
água por semana. Isso fornece ampla oportunidade para que impurezas na água
sejam entregues ao animal. A água potável contém concentrações seguras de íons metálicos e
outros solutos para consumo oral. O trato gastrointestinal cria
uma barreira que impede ainda mais a absorção excessiva desses solutos. O
hemodialisador facilita o fluxo bidirecional de solutos dentro do dialisato,
incluindo esses contaminantes, que podem passar pela membrana e se difundir no
sangue do animal, criando uma oportunidade para complicações comórbidas ou
fatais. Para diminuir o risco de
filtração reversa, uma taxa mínima de ultrafiltração pode ser definida, e
qualquer remoção indesejada de fluido pode ser compensada com administração de
fluido intravenosa ou no sistema extracorpóreo. Como a magnitude da
exposição é muito maior na diálise, íons metálicos e
solutos nocivos devem ser removidos para tornar a água segura para diálise.
Os
componentes necessários para produzir água purificada (conhecida como água do
produto) dependem da qualidade da fonte de água municipal. Dispositivos como
filtros de água de sedimentos, tanques de troca de carbono e amaciadores de
água podem ser necessários para preparar a água para purificação adicional
. Osmose reversa e
deionização são os métodos mais comuns de purificação de água. A osmose reversa
utiliza uma membrana semipermeável através da qual a água é empurrada. Isso
remove solutos e bactérias, produzindo uma água do produto pura. A deionização
pode remover solutos dissolvidos, mas não remove bactérias, portanto, pode
fornecer água do produto pura, mas tem um risco maior de colonização bacteriana
e formação de biofilme. A osmose reversa é recomendada devido à segurança
aprimorada na remoção de bactérias.
Declaração:
A osmose reversa (RO) é o método preferido de purificação de água para uso na
geração de dialisato (92% de concordância).
Todos
os componentes usados para a criação da água do produto podem falhar
inesperadamente e sem aviso, portanto, o monitoramento de rotina da água do
produto é necessário. Agências de saúde governamentais locais ou nacionais
criam tolerâncias seguras para íons metálicos e outros solutos contaminantes na
água do produto. A água do produto deve ser amostrada o mais próximo possível
da máquina de osmose reversa, antes da conexão com a máquina de diálise. Da
mesma forma, o dialisato deve ser amostrado o mais próximo possível do
hemodialisador. A água do produto e o dialisato devem ser cultivados usando
meios de cultura especiais e testados para endotoxina trimestralmente para
monitorar a colonização bacteriana. Não é aceitável usar meios de cultura ou
procedimentos aplicáveis para indicações clínicas, pois esses materiais não
identificarão contaminantes típicos da água. A água deve ser analisada quanto à
qualidade da água duas vezes por ano. Os testes de água e dialisato devem ser
realizados por um laboratório com métodos analíticos específicos para a
qualidade e segurança da água. Os relatórios de qualidade da água e cultura
devem ser rastreados em um log para monitorar tendências no crescimento
bacteriano e contaminação por metais. Se as contagens bacterianas ou
concentrações de soluto excederem o limite seguro recomendado, a diálise usando
água impura ou água ou equipamento contaminados não deve ser realizada até que
a fonte dessas contaminações seja identificada e retificada. Testes de água do
produto e dialisato podem precisar ser realizados com mais frequência quando a
solução de problemas identificar contaminação e a diálise não puder ser realizada
até que todos os testes estejam em conformidade com os limites de segurança
recomendados.
Declaração:
O teste de água do produto deve ser realizado de acordo com os padrões
regulatórios ou da indústria local. O uso de filtros de carbono, filtros de
partículas e dispositivos amaciadores de água é frequentemente usado para criar
água segura para o produto. A cultura da água deve ser realizada pelo menos
trimestralmente, ou de acordo com os padrões regulatórios regionais, o que for
mais frequente. A análise de metais e solutos deve ser realizada pelo menos
duas vezes por ano ou conforme recomendado pelos padrões regionais para
qualidade da água (92% de concordância).
Declaração:
As diretrizes da Association for the Advancement of Medical Instrumentation
(AAMI) recomendam que a água do produto e o dialisato contenham <100 UFC/mL
de bactérias e <0,25 UE/mL de endotoxina para serem considerados seguros
para geração e tratamento de dialisato, respectivamente. No entanto, ações de
limpeza devem ser realizadas no sistema de purificação de água quando a água do
produto contiver >50 UFC/mL de bactérias e >0,125 UE/mL de endotoxina. O
uso de um ultrafiltro na máquina de diálise gera dialisato ultrapuro, que
contém <0,1 UFC/mL de bactérias e <0,03 UE/mL de endotoxina. Quando os
resultados dos testes estiverem fora desses limites, a desinfecção e a solução
de problemas devem ser realizadas para retornar a água, o dialisato do produto
e o dialisato ultrapuro aos limites recomendados. Quando o dialisato excede
essas recomendações, não é seguro entregá-lo aos animais até que os problemas
sejam corrigidos (100% de concordância).
Anticoagulação
A
coagulação do circuito extracorpóreo é uma das complicações mais comuns da
hemodiálise.
Portanto, a grande maioria dos animais submetidos à hemodiálise deve ser
anticoagulada durante o tratamento. A heparinização sistêmica é o método de
anticoagulação mais comumente usado para hemodiálise intermitente, entretanto,
quando o risco de sangramento é considerado alto, outras alternativas, incluindo
a anticoagulação regional e tratamentos mínimos ou nenhum tratamento com
heparina devem ser considerados. Antes do início da hemodiálise, uma avaliação
abrangente do estado de coagulação do animal é realizada para selecionar o
método apropriado e mais seguro de anticoagulação.
Declaração: As considerações mínimas
para a prescrição de anticoagulação de um animal a ser dialisado pela primeira
vez devem incluir evidências históricas de sangramento (hemoptise, epistaxe , melena , hematoquezia , procedimentos realizados
recentemente), um exame físico completo avaliando evidências de hematomas,
petéquias, sangramento gengival , hifema , evidências de hemorragia pulmonar e avaliação do hematócrito e
contagem de plaquetas. Antes de qualquer tratamento de diálise, um perfil de
coagulação abreviado [por exemplo, tempo de coagulação ativado (TCA)] deve ser realizado para orientar
a prescrição de heparina não fracionada sistêmica. Um cálcio ionizado deve ser
medido para orientar a prescrição de anticoagulação regional com citrato.
Dependendo da etiologia suspeita e das comorbidades, o risco hemorrágico ou
trombótico deve ser avaliado posteriormente com testes adicionais. Para
tratamentos subsequentes, um histórico atualizado (incluindo resposta à
anticoagulação anterior, sangramento, coagulação do circuito) e hematócrito
normalmente são suficientes (100% de concordância).
A seleção do método de anticoagulação
deve considerar o estado atual de coagulação do animal e o risco de sangramento
associado a procedimentos anteriores ou futuros que podem predispor ao
sangramento. Alguns procedimentos considerados benignos (por exemplo,
cistocentese) podem resultar em sangramento grave após anticoagulação sistêmica
imediatamente após o procedimento ou realizados após um tratamento de diálise
quando o animal ainda está anticoagulado.
Declaração: A heparinização sistêmica
é a anticoagulação padrão prescrita para hemodiálise intermitente em animais
sem risco identificado de complicações hemorrágicas. Em animais com alto risco
de complicações hemorrágicas, protocolos alternativos de anticoagulação devem
ser considerados; o protocolo mais bem estabelecido é a anticoagulação regional
com citrato (RCA). Quando não disponível, tratamentos com heparina mínima ou
sem anticoagulação devem ser considerados (100% de concordância).
Declaração: Animais com alto risco de
complicações hemorrágicas (animais com distúrbios hemostáticos ou animais que necessitam de
procedimentos diagnósticos ou terapêuticos invasivos
pendentes) não devem ser anticoagulados sistemicamente. Animais
hipercoaguláveis têm risco aumentado de coagulação do circuito extracorpóreo
ou de desenvolver tromboses sistêmicas e podem necessitar de anticoagulação e
monitoramento mais intensivos durante e entre os tratamentos (100% de
concordância).
Declaração: Procedimentos invasivos
devem ser evitados durante o período de peridiálise ao usar heparinização
sistêmica. Isso inclui intervenções menores, como punção venosa , aspiração por agulha fina ou cistocentese , pois podem causar hemorragias
fatais. O período de peridiálise é no mínimo >1 h antes do tratamento e 6 h após o tratamento, mas esses tempos
variam com a invasividade do procedimento e a capacidade de observar se ocorre
sangramento (100% de concordância).
Declaração: O protocolo padrão para
heparinização sistêmica inclui um bolus inicial seguido por uma infusão de taxa
constante para prolongar o tempo de coagulação basal em 160–200% (por exemplo,
160–200 segundos
para ACT). O bolus inicial recomendado é de 50 U/kg IV de heparina não
fracionada para cães e 25 U/kg IV para gatos. O tempo de coagulação deve ser
avaliado antes da administração de heparina e reavaliado dentro de 5–10 minutos após, para determinar se a
meta de anticoagulação foi alcançada antes do início do tratamento. Se a meta
inicial de anticoagulação não for alcançada, um bolus adicional deve ser
administrado até que a meta seja alcançada. Uma infusão de taxa constante de 50
U/kg/h (cães) e 25 U/kg/h (gatos) é iniciada imediatamente com o início do
tratamento. Uma avaliação adicional do tempo de coagulação deve ser realizada a
cada 30–60 minutos durante todo o tratamento. A dose
inicial e a taxa contínua de administração de heparina são ajustadas com base
nos resultados das medições do tempo de coagulação, do tempo de trânsito
extracorpóreo, da fração de filtração, da evidência visual de coagulação no
circuito extracorpóreo, das alterações na eficiência do tratamento e do risco
geral de coagulação ou sangramento. (92% de concordância)
As respostas anticoagulantes à dosagem
recomendada de heparina variam consideravelmente entre os animais e entre os
tratamentos no mesmo animal. O bolus inicial de heparina e a administração de
taxa constante de heparina durante todo o tratamento devem ser ajustados com
base nos riscos avaliados de sangramento, coagulação no circuito extracorpóreo
e na medição de ACT basal e subsequente antes de administrar a dose de
preparação e ajustar a administração de taxa constante, respectivamente. Uma
medição de ACT basal excessivamente alta pode resultar da administração
inadvertida de heparina da solução de bloqueio do cateter durante o
processamento do cateter. Resultados de coagulação basal ou em tratamento
inesperados ou espúrios devem levar à reavaliação da medição antes da
administração ou ajuste da heparina.
Para tratamentos subsequentes, as
respostas a administrações anteriores de heparina devem ser consideradas. O
risco de sangramento é maior em tratamentos iniciais quando distúrbios de coagulação
coexistentes são mais prováveis e ainda precisam ser abordados. Isso
inclui disfunção plaquetária devido à uremia e distúrbios
intrínsecos de coagulação (por exemplo, coagulação intravascular disseminada)
associados à doença predisponente ou suas comorbidades e complicações.
Declaração: A evidência clínica de
hemorragia durante o tratamento deve ser avaliada por testes repetidos de
anticoagulação para direcionar o ajuste da prescrição. Hemorragia oculta ocorrendo durante todo o tratamento de
IHD pode incluir uma tendência decrescente no hematócrito, um aumento aparente
na avaliação do volume sanguíneo com monitoramento de hematócrito em linha,
hipotensão, diminuição da oxigenação venosa central, taquicardia , membranas mucosas pálidas e taquipneia . Se estes forem observados, o
volume sanguíneo aparente e o hematócrito do animal devem ser avaliados. Se os
parâmetros de anticoagulação estiverem acima do alvo (por exemplo, ACT>200 seg), a anticoagulação deve ser
descontinuada ou pelo menos rapidamente diminuída, até que os parâmetros de
coagulação retornem aos valores alvo. A administração de suporte de
hemoderivados deve ser considerada conforme indicado (100% de concordância).
Monitoramento
Todos os tratamentos de hemodiálise
exigem monitoramento rigoroso por pessoal treinado. Exame físico completo, parâmetros
clínicos basais (por exemplo, pressão arterial, frequência e ritmo cardíacos , hidratação, palidez,
temperatura, estado mental, condição corporal, produção de urina,
características das fezes) e parâmetros laboratoriais precisam ser revisados
e registrados antes do início da hemodiálise. Esses parâmetros clínicos e
laboratoriais basais facilitam a interpretação dos achados clínicos durante o
tratamento, incluindo a identificação de sinais clínicos sutis (por exemplo,
nistagmo, vocalização, inquietação, taquicardia) e a necessidade de ajustes no
tratamento médico em andamento.
Declaração: Parâmetros fisiológicos
basais devem ser avaliados e registrados em todos os animais antes de iniciar a
hemodiálise intermitente, incluindo estado de hidratação, frequência cardíaca,
tempo de enchimento capilar , pressão arterial sistêmica, frequência
e esforço respiratório e temperatura corporal. A correção da hipotensão e
hipovolemia deve ser abordada antes do início do tratamento (100% de
concordância).
O monitoramento deve ser realizado
durante a IHD por clínicos ou técnicos treinados que estejam familiarizados com
a hemodiálise e suas potenciais complicações. Nas mãos de clínicos e técnicos
bem treinados, a maioria das complicações da hemodiálise (por exemplo,
sangramento, coagulação, desequilíbrio da hemodiálise) pode ser identificada em
tempo hábil e tratada adequadamente para evitar complicações piores ou mais
graves. O monitoramento contínuo do ECG é recomendado durante as 2–3 sessões
iniciais de diálise ou em sessões nas quais há suspeita de que o animal pode
ter arritmias tratáveis com risco de vida que precisam de monitoramento contínuo.
Animais com risco identificado ou elevado de hipercalemia devem ter
monitoramento do ECG para avaliar o risco cardiovascular associado ao aumento
do potássio. Bradiarritmias antes ou durante o tratamento de
diálise podem sugerir aumento do tônus vagal que deve ser controlado
proativamente com medicamentos anticolinérgicos para aumentar a frequência cardíaca e
evitar uma parada cardíaca súbita induzida pelo vagal. Taquiarritmias ventriculares são comumente observadas em
animais gravemente urêmicos e podem não exigir intervenção; no entanto, algumas
podem ser fatais e devem ser identificadas e tratadas.
Declaração: O monitoramento deve ser
realizado por pessoal treinado e registrado antes e depois do tratamento e a
cada 30 minutos durante todo o tratamento. O monitoramento mais
frequente é justificado em animais instáveis. No mínimo, frequência cardíaca,
frequência respiratória, temperatura corporal e pressão arterial devem ser
medidas e registradas para revisão e tendência. O monitoramento da saturação
venosa central de oxigênio, alterações no volume sanguíneo e hematócrito são
essenciais para garantir a segurança durante a diálise, particularmente quando
a ultrafiltração é realizada. Idealmente, esses parâmetros são realizados em
tempo real usando um monitor de volume sanguíneo e saturação de oxigênio em
linha (92% de concordância).
Declaração: O monitoramento da pressão
arterial deve ser mais frequente durante o primeiro tratamento, pois o risco de
hipotensão é maior devido às consequências da uremia, distúrbios eletrolíticos
e ácido-básicos graves, remoção rápida de solutos resultando em deslocamento de
fluido para fora do compartimento vascular, intensidade da ultrafiltração,
medicamentos com potenciais efeitos vasoativos (anti-hipertensivos, diuréticos, anestésicos) e comorbidades (perdas
de fluidos gastrointestinais, hemorragia, sepse , pancreatite) (concordância de
100%).
Declaração: O monitoramento contínuo
do eletrocardiograma é recomendado para identificar arritmias durante os primeiros dois a três
tratamentos. Arritmias são comuns em animais urêmicos durante os tratamentos
iniciais (contrações ventriculares prematuras), mas a intervenção geralmente
não é indicada, a menos que esteja associada a comprometimento hemodinâmico.
Arritmias causadas pelo cateter podem justificar a diminuição do fluxo
sanguíneo (100% de concordância).
Animais com LRA grave são
frequentemente hipertensos, no entanto, a hipotensão é uma complicação
potencial e séria da DCI. A hipotensão pode resultar de um volume
excessivamente grande do circuito extracorpóreo, ultrafiltração agressiva,
hemorragia e complicações associadas à LRA ou comorbidades (por exemplo, doença cardíaca concomitante, sepse,
pancreatite). A pressão arterial é, portanto, monitorada frequentemente durante
todo o tratamento.
Declaração: A pressão arterial deve
ser medida imediatamente antes de iniciar o tratamento, imediatamente após o
início do tratamento e dentro de 10 minutos do início do tratamento. A pressão arterial deve
ser medida pelo menos a cada 10–15 minutos durante os primeiros 30 minutos do tratamento, pois os animais
podem desenvolver hipotensão e comprometimento cardiovascular após seu sangue
ter preenchido o circuito extracorpóreo. Durante o restante do tratamento, as
medições devem ser realizadas pelo menos a cada 30 minutos (100% de concordância).
Declaração: Pressão arterial alvo: a
administração de medicamentos anti-hipertensivos deve ser cuidadosamente
considerada antes do tratamento de diálise para evitar hipotensão intradialítica
refratária. A pressão arterial sistólica deve ser mantida entre 120 –
160 mmHg durante o tratamento. As medições da pressão arterial devem ser interpretadas à luz do
histórico de pressão arterial do animal, evidência de dano ao órgão alvo,
frequência cardíaca, saturação venosa central de oxigênio e nível de estresse.
Se as medições da pressão arterial estiverem persistentemente acima da faixa
alvo, os animais devem ser avaliados quanto a distúrbios na terapia
anti-hipertensiva, estado do volume, vasodilatação, ansiedade e dor (100% de
concordância).
Declaração: Intervenções em animais
com hipertensão devem ser iniciadas para tratar a causa subjacente da pressão arterial anormal (por exemplo, ultrafiltração
inadequada para hipervolemia, sedação/ansiolítico para estresse,
etc.). Se a pressão arterial sistólica estiver persistentemente (três medições
em 30–60 minutos)
acima de 180 mm
Hg durante o tratamento, as metas de ultrafiltração devem ser reavaliadas e o
tratamento anti-hipertensivo é indicado. Em face de medicamentos
anti-hipertensivos, os animais são suscetíveis à hipovolemia durante a
ultrafiltração, exigindo monitoramento mais próximo (100% de concordância).
|
Monitoração do paciente em diálise Pre; Inter e Pós |
||||||||
|
Iniciado em: Horários |
|
|
|
|
|
|
|
|
|
|
Basal |
a cada 30 minutos |
|
|
|
|
|
|
|
Fluido
(tipo/volume) |
|
|
|
|
|
|
|
|
|
Fluido (mL/kg/h) |
|
|
|
|
|
|
|
|
|
Ultrafiltração |
|
|
|
|
|
|
|
|
|
Desidratação % |
|
|
|
|
|
|
|
|
|
Heparina 50 U/kg IV
de heparina não fracionada para cães e 25 U/kg IV para gatos ou (50UI/250mL) |
|
|
|
|
|
|
|
|
|
ACT antesda
heparina e 5-10 minutos após, depois de 30/30 minutos <200 seg |
|
|
|
|
|
|
|
|
|
hematócrito |
|
|
|
|
|
|
|
|
|
PAS_____no manguito |
1. |
2. |
5. |
6. |
7. |
8. |
9. |
10. |
|
PAS ideal 120 a 160
mmHg |
|
3. |
|
|
|
|
|
|
|
PAS |
|
4. |
|
|
|
|
|
|
|
Para animais que
desenvolvem hipotensão intradialítica, a ultrafiltração deve ser interrompida
temporariamente, ou a taxa de ultrafiltração deve ser reduzida minimamente.
Esforços para melhorar a hipotensão em animais hipovolêmicos incluem expansão
inicial criteriosa do volume com fluidos cristaloides, seguidos por soluções
coloidais sintéticas, substâncias osmoticamente ativas (por exemplo, manitol)
ou hemoderivados, conforme indicado. Para hipotensão intradialítica
persistente refratária à expansão do volume, vasopressores podem ser
necessários. Estratégias alternativas incluem resfriar o dialisato e/ou
aumentar a concentração de sódio do dialisato. Em animais persistentemente
hipotensos, o término da sessão de diálise e o enxágue imediato podem ser
necessários |
||||||||
|
F.R. m.r.p |
|
|
|
|
|
|
|
|
|
F.C. b.p.m |
|
|
|
|
|
|
|
|
|
Temperatura retal |
|
|
|
|
|
|
|
|
|
Mucosas |
|
|
|
|
|
|
|
|
|
TPC |
|
|
|
|
|
|
|
|
|
Escala de dor 1-10 |
|
|
|
|
|
|
|
|
|
Glasgow 3-18 |
|
|
|
|
|
|
|
|
|
Saturação O2 |
|
|
|
|
|
|
|
|
|
ECG |
|
|
|
|
|
|
|
|
|
POCUS coração |
|
|
|
|
|
|
|
|
|
|
||||||||
|
Perdas |
|
|
|
|
|
|
|
|
|
Êmese |
|
|
|
|
|
|
|
|
|
Fezes |
|
|
|
|
|
|
|
|
|
Urina (mL) |
|
|
|
|
|
|
|
|
|
Débito urinário |
|
|
|
|
|
|
|
|
|
Oxigênio |
|
|
|
|
|
|
|
|
|
Aproximadamente 5
dias são necessários após o último tratamento de diálise para ver a
estabilização da azotemia e revelar a função. Marcadores da função renal (por
exemplo, creatinina sérica, ureia) devem ser realizados antes e depois da
diálise. Reduções sequenciais pré-diálise na ureia e creatinina ou reduções
na inclinação interdialítica da ureia e/ou creatinina sugerem melhora na
função renal residual. Marcadores de recuperação também incluem um aumento na
produção de urina excretora residual
do animal. Vários dias adicionais podem ser necessários para identificar
complicações ou sinais progressivos antes que decisões possam ser tomadas
para descontinuar a diálise |
||||||||
|
Princípio Ativo
- mg/mL |
Dose |
Via |
mL/cp |
8 |
12 |
16 |
20 |
|
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
11 |
|
|
|
|
|
|
|
|
|
Quando os riscos de
sindrome do desequilíbrio são considerados altos, a administração intravenosa
profilática de manitol (0,5–1,0 g/kg) deve ser considerada durante ou após o
término do tratamento. Os fatores de risco incluem tamanho pequeno (<6
kg), azotemia grave (BUN >300 mg/dl) (107,1 mmol/L), sinais
neurológicos preexistentes e intensidade do tratamento maior do que as
diretrizes |
||||||||
Declaração: A hiperidratação é um dos
principais fatores que contribuem para a hipertensão, e esforços devem ser
direcionados para atingir e manter o peso corporal seco ideal durante e após o
tratamento para auxiliar no controle da pressão arterial (100% de
concordância).
Declaração: Para animais que
desenvolvem hipotensão intradialítica, a ultrafiltração deve ser interrompida
temporariamente, ou a taxa de ultrafiltração deve ser reduzida minimamente.
Esforços para melhorar a hipotensão em animais hipovolêmicos incluem expansão
inicial criteriosa do volume com fluidos cristaloides, seguidos por soluções
coloidais sintéticas, substâncias osmoticamente ativas (por exemplo, manitol) ou
hemoderivados, conforme indicado. Para hipotensão intradialítica persistente
refratária à expansão do volume, vasopressores podem ser necessários.
Estratégias alternativas incluem resfriar o dialisato e/ou aumentar a
concentração de sódio do dialisato. Em animais persistentemente hipotensos, o
término da sessão de diálise e o enxágue imediato podem ser necessários (92% de
concordância).
Declaração: As medições da pressão
arterial devem ser obtidas após o enxágue no término do tratamento, mas devem
ser interpretadas à luz da expansão do volume sanguíneo durante o enxágue, o
que pode causar aumentos transitórios na pressão arterial até que o volume do
enxágue seja distribuído. Uma medição adicional da pressão arterial deve ser
obtida 30–60 minutos após o término do tratamento para determinar a
necessidade de intervenção terapêutica ou monitoramento mais próximo se houver
preocupação após a avaliação imediata da pressão arterial pós-enxágue (92% de
concordância).
Momento
da descontinuação
Pode ocorrer recuperação suficiente da
função renal em animais dialisados para suporte de LRA para se tornarem
independentes de diálise e manterem uma qualidade de vida aceitável. O monitoramento serial da creatinina
sérica ajuda a prever a recuperação da função renal, mas cada animal pode ter
uma tolerância diferente à uremia persistente. Se a azotemia tiver sido
resolvida ou melhorada para níveis quase normais, a maioria dos animais não
precisará mais de hemodiálise contínua e pode ser tratada clinicamente. Quando há retorno moderado da função
renal residual, os animais podem receber um período de férias da diálise para
permitir que seus donos avaliem o apetite, o nível de energia e a recorrência
de sinais urêmicos na ausência de diálise. Se estes forem aceitáveis, o cateter
pode ser removido e o animal continua no tratamento apropriado para seu estágio
atual de função renal. Se os sinais urêmicos forem excessivos, a hemodiálise
pode ser continuada indefinidamente para dar suporte à função renal e à qualidade de vida . Aproximadamente 5 dias são
necessários após o último tratamento de diálise para ver a estabilização da
azotemia e revelar a função excretora residual do animal. Vários dias
adicionais podem ser necessários para identificar complicações ou sinais
progressivos antes que decisões possam ser tomadas para descontinuar a diálise.
O cateter de diálise normalmente
é deixado no lugar durante esse tempo para permitir uma reintrodução mais fácil
da diálise, se necessário. No entanto, o cateter é um risco de tromboembolismo e
infecção, e pode ser removido mais cedo em animais com altos riscos dessas
complicações.
Declaração: O esquema de diálise deve ser mantido até que
o animal recupere a função renal suficiente para se tornar independente de diálise,
ou seja, quando os sinais clínicos e as anormalidades laboratoriais puderem ser
controlados apenas com tratamento médico. Os animais que não recuperarem a
função suficiente podem ser tratados indefinidamente (100% de concordância).
Declaração: Marcadores da função renal (por exemplo,
creatinina sérica, ureia) devem ser realizados antes e depois da diálise.
Reduções sequenciais pré-diálise na ureia e creatinina ou reduções na
inclinação interdialítica da ureia e/ou creatinina sugerem melhora na função
renal residual. Marcadores de recuperação também incluem um aumento na produção
de urina (100% de concordância).
Declaração: A maioria dos animais faz a transição
bem-sucedida da terapia de diálise quando a concentração de creatinina sérica
pré-diálise é < 5 mg/dL (≤442 mmol/L) 3–5 dias após o tratamento de
diálise. Alguns animais, no entanto, permanecem sintomáticos para uremia e se
beneficiam da terapia de diálise contínua em concentração de creatinina sérica
abaixo desse limite. Por outro lado, os animais podem ter uma qualidade de vida
aceitável sem diálise em concentrações mais altas de creatinina. Um mínimo de 5
dias deve ser permitido para o equilíbrio da creatinina após o tratamento ao
avaliar a função renal residual. (92% de concordância)
Declaração: Ao considerar a descontinuação da diálise em
animais com recuperação parcial, o cateter de diálise deve ser mantido por 7
dias após o último tratamento proposto. Isso permite a oportunidade de retomar
os tratamentos de diálise se a função renal residual for insuficiente para a
transição para o tratamento médico (concordância de 83%).
Complicações
A hemodiálise é
geralmente um padrão avançado e seguro de tratamento para cães e gatos que têm
disfunção renal com risco de vida que não
pode ser tratada clinicamente. No entanto, existem inúmeras complicações
potenciais associadas a procedimentos extracorpóreos que são frequentemente
atenuadas por provedores experientes e equipamentos apropriados e procedimentos
padronizados. Os clínicos e técnicos devem ser adequadamente treinados, e as
instalações devem ser adequadamente equipadas antes de tratar animais com
qualquer terapia extracorpórea, incluindo
IHD. Uma das preocupações mais sérias, mas pouco frequentes, é a DDS, que
resulta de uma taxa excessivamente agressiva e insegura de redução de ureia.
Essa complicação potencialmente letal deve ser prevenida identificando animais
em risco, seguindo as diretrizes para prescrições seguras de URR/h e agindo proativamente
quando houver suspeita de sinais clínicos durante o tratamento. Em cães, os
sinais clínicos são frequentemente insidiosos e oferecem oportunidade para
intervenção, no entanto, em gatos, a morte aguda pode ser o primeiro e único
sinal de DDS; portanto, extremo cuidado precisa ser exercido durante o
tratamento dialítico de azotemia grave nesta espécie.
Declaração:
Quando os riscos de DDS são considerados altos, a administração intravenosa
profilática de manitol (0,5–1,0 g/kg) deve ser considerada durante ou
após o término do tratamento. Os fatores de risco incluem tamanho pequeno
(<6 kg),
azotemia grave (BUN >300 mg/dl) (107,1 mmol/L), sinais neurológicos preexistentes e
intensidade do tratamento maior do que as diretrizes (92% de concordância).
Declaração:
Os sinais clínicos de DDS durante um tratamento de IHD exigem ação imediata. A administração
de diálise deve ser pausada usando bypass, e manitol intravenoso
(1,0 g/kg) deve ser administrado. Em caso de convulsões atribuídas
a DDS, diazepam deve ser administrado para fazer
efeito, e o tratamento deve ser descontinuado. Se os sinais neurológicos não
responderem a essas intervenções, é indicado um trabalho diagnóstico adicional
para descartar hemorragia
intracraniana e hérnia do tronco cerebral (92%
de concordância).
Animais
com LRA grave correm risco de sangramento por vários motivos, incluindo disfunção plaquetária e
distúrbios de coagulação (por exemplo, DIC). O risco aumenta ainda mais quando
a hemodiálise é iniciada usando heparinização sistêmica. Procedimentos
invasivos podem ser realizados logo antes do início da diálise ou após o
término, incluindo a colocação de um cateter de diálise ou sonda de
alimentação. O risco de sangramento deve ser avaliado individualmente. Quando o
risco de sangramento é considerado muito alto, ou quando há evidência de
sangramento ativo, uma estratégia de anticoagulação sem heparina, heparina
mínima ou regional (por exemplo, citrato) deve ser considerada.
Declaração: Animais
tratados com hemodiálise correm risco de sangramento. O sangramento pode
ocorrer devido à uremia (diminuição da função plaquetária, ulceração gastrointestinal), à
doença subjacente (por exemplo, hemorragia pulmonar associada à leptospirose),
distúrbios de coagulação concomitantes (por exemplo, DIC) ou devido à
heparinização sistêmica intradialítica. Deve-se dar atenção ao local de
inserção do cateter de diálise ou a quaisquer outras intervenções invasivas,
pois pode ocorrer sangramento durante ou após os tratamentos iniciais usando
anticoagulação sistêmica com heparina. Hipotensão ou hipovolemia durante ou
após o tratamento de diálise devem levar à avaliação de sangramento interno
(cavidades corporais, trato gastrointestinal, pulmões) (100% de concordância).
Resumo
A hemodiálise intermitente é uma terapia extracorpórea excepcionalmente
eficaz usada na medicina veterinária principalmente para tratar
animais com LRA grave quando o tratamento médico é insuficiente ou se espera
que seja insuficiente para controlar as consequências clínicas da doença.
Terapias extracorpóreas em geral, e IHD especificamente, podem expandir a
janela de oportunidade para recuperação de animais urêmicos e animais expostos
a intoxicações selecionadas com risco de vida. A maioria dos animais
sobreviventes com LRA grave ou doença renal aguda sobre crônica tratada por IHD
se recuperam nas primeiras semanas de tratamento; no entanto, a duração do
tratamento pode se estender por meses antes que a recuperação ocorra, e alguns
animais nunca recuperam a função renal suficiente para se tornarem
independentes de diálise. A probabilidade de recuperação depende da
etiologia, da extensão da lesão renal e da janela de oportunidade
fornecida pela intervenção dialítica para recuperação renal. É muito importante
ter uma conversa sobre expectativas realistas com os donos de animais de
estimação antes de iniciar esses tratamentos avançados.
Animais administrados por hemodiálise
requerem tratamento médico semelhante ao requisito para graus ou estágios
comparáveis de doença renal aguda ou crônica, além da hemodiálise. No entanto,
existem alguns requisitos exclusivos de animais mantidos com hemodiálise que
precisam ser considerados. Alguns desses animais persistem na hemodiálise por
semanas ou meses com capacidade mínima ou nenhuma de excreção de fluidos,
eletrólitos ou drogas. A maioria dos animais mantidos em
hemodiálise são alimentados por meio de sondas de alimentação para atender às
suas necessidades calóricas e anular seu estado catabólico. Essa combinação
pode criar hiperidratação crônica, desequilíbrios eletrolíticos e ácido-base
potencialmente graves e acúmulos de medicamentos desconhecidos para a maioria
dos clínicos. Portanto, monitoramento frequente e ajustes no tratamento
dialítico e médico precisam ser feitos e aplicados nos períodos dialítico e
interdialítico, respectivamente.
Os
clínicos que realizam hemodiálise precisam estar extremamente familiarizados
com os aspectos teóricos e técnicos desta modalidade de tratamento, incluindo a
compreensão da operação do equipamento de hemodiálise, prescrição de tratamento
apropriada e individualizada, e monitoramento e manuseio de complicações durante
e entre os tratamentos de diálise. Nas mãos de clínicos e técnicos bem
treinados, esta terapia é muito segura e eficaz com uma baixa taxa de
complicações. Em alguns estudos retrospectivos de escala relativamente grande
avaliando o resultado de LRA em animais tratados por hemodiálise, a taxa de mortalidade foi
de aproximadamente 50% (incluindo eutanásia) com
um resultado favorável a longo prazo para os sobreviventes que, de outra forma,
não teriam essencialmente nenhuma expectativa de sobrevivência.
Manutenção da máquina
A manutenção da máquina
envolve limpeza interna de rotina e limpeza intermitente da máquina calibração.
No final de cada dia de tratamento, o técnico pode ser solicitado a colocar a
máquina em um ciclo de enxágue para remover o bicarbonato da tubulação e evitar
a precipitação. Um ciclo de limpeza envolvendo alvejante remove quaisquer
depósitos de proteína da tubulação do dialisato. Algumas das máquinas mais
novas executam essas limpezas automaticamente, sem intervenção do técnico. A desinfecção semanal deve fazer parte da
rotina da unidade de diálise. A desinfecção química pode ser realizada
usando uma variedade de produtos de limpeza. A mistura de ácido peroxiacético e
peróxido de hidrogênio (Actril; Minntech, Minneapolis, MN, EUA) é popular. A
solução de limpeza é distribuída por toda a tubulação interna da máquina
através das portas de ácido e bicarbonato e pode permanecer por vários minutos
a horas. Em muitas unidades, o ciclo de desinfeção é iniciado ao final do dia,
pelo que o período de permanência ocorre durante a noite. Há um ciclo de
enxágue obrigatório depois, e o técnico deve verificar se não há desinfetante
residual no dialisante (geralmente usando um simples teste de vareta).
Algumas máquinas também
podem realizar um clico de desinfecção por calor, que aquece a água na
tubulação por várias horas para destruir qualquer bactéria contaminantes. Em
máquinas que são capazes de desinfecção química e térmica. Recomenda-se
alternar semanalmente.
Algumas substâncias como
uréia ou potássio possuem concentrações extracelulares baixas no sague, e após
a terapia dialitica, aumentam em algumas horas devido difusão intracelular pós
diálise. Esse grau de rebote depende da taxa de diálise.
“É importante ressaltar
após uma terapia dialitica que não se importa com a remoção de produtos residuais
e sim o quanto é deixado para trás”
Ex: O paciente nº 1 inicia
a diálise 4 horas 3 vezes por semana no dia 0. O paciente nº 2 inicia a diálise
2 horas 6 vezes por semana no dia 0.
A diálise mais eficiente
ocorre no inicio da diálise, pois na 1ª. Hora de diálise o BUN seria 100 mg/dL;
2ª. Hora 75mg/dL; 3ª.hora 40mg/dL e na 4ª. Hora 25 mg/dL.
O paciente 2 terá uma
depuração maior por causa do rebote.
Com o primeiro paciente a
3ª e 4ª. Hora de diálise acontece após as primeiras 2 horas e não há chance de
ter ocorrido rebote, enquanto no segundo paciente, a 3ª e 4ª hora de diálise
ocorre no dia seguinte após o rebote.
O artigo original pode ser encontrado em: https://pubmed.ncbi.nlm.nih.gov/38442779/
Referencias
BLOOM, C.A.; LABATO, M.A. Intermittent Hemodialysis for
Small Animals. Vet Clin Small Anim 41 (2011) 115–133.
CARVALHO, M. B. Semiologia do sistema urinário. In: FEITOSA, F.
L. F. Semiologia Veterinária: A arte do diagnóstico. Edição Português.
São Paulo: Roca, 2020.
CARLY, A.B.; LABATO, M.A. Intermittent
Hemodialysis for small animals. Vet Clin Small Anim 41 (2011) 115–133
CHALHOUB, S.; LANGSTON,
C.E.; POEPPEL, K. Vascular Access for Extracorporeal Renal Replacement Therapy
in Veterinary Patients. Vet Clin Small Anim 41 (2011) 147–161.
COWGILL, L. D.; Urea Kinetics and Intermittent
Dialysis Prescription in Small Animals. Vet Clin Small Anim 41 (2011) 193–225.
COWGILL, L. D.; ELLIOTT, D.A. Hemodialysis. In:
DiBartola SP, editor. Fluid therapy in small animal practice. 2nd edition.
Philadelphia: WB Saunders; 2000. p. 528–47.
DUNN, M.; BROOKS, M.J. Antiplatelet and anticoagulant
therapy. In: Bonagura JD, Twedt DC, editors. Kirk’s current veterinary therapy
XIV. St Louis (MO): Saunders Elsevier; 2009. p. 24–8
ELLIOTT, D.A. Hemodialysis. Clin Tech Small Anim
Pract 2000;15:136–48.
GROMAN, R. Apheresis in veterinary medicine:
therapy in search of a disease. In: Proceedings of the Advanced Renal Therapies
Symposium. 2010. p. 26–32.
GOBE, G. C.; JOHNSON, D. W. Distal tubular
epithelial cells of the kidney: Potential support for proximal tubular cell
survival after renal injury. The International Journal of Biochemistry &
Cell Biology, Exeter. v. 39, p. 1551-1561, 2007
KÖNIG, H.E.; MAIERL, J.; LIEBICH, H.G.; Sistema Urinário. In:
KÖNIG, H.E.; LIEBICH, H.G. Anatomia dos animais domésticos. Texto e
atlas colorido. Artmed. 6ª.Edição. Porto Alegre: Artmes, p. 399-411. 2016.
MOREIRA, SABRINA DE ALMEIDA. Avaliação de
sessões de hemodiálise em cães portadores de injúria renal aguda associada à
infecções. Dissertação (mestrado) - Universidade Estadual Paulista, Faculdade
de Medicina Veterinária e Zootecnia. Botucatu, 2013, 94p.
POEPPEL, K.; LANGSTON, C.; CHALHOUB, S.
Equipment Commonly Used in Veterinary Renal Replacement Therapy. Vet Clin Small
Anim 41 (2011) 177–191.
ROSS,S. Anticoagulation in Intermittent
Hemodialysis: pathways, Protocols, and pitfalls. Vet Clin Small Anim 41 (2011)
163–175.
SAM, R.
Hemodialysis: Diffusion and Ultrafiltration. Austin J Nephrol Hypertens.
2014;1(2): 1010.
STANLEY, S.W.; LANGSTON, C.E. Hemodialysis in a
dog with acute renal failure from currant toxicity. CVJ / VOL 49 / JANUARY,
2008.

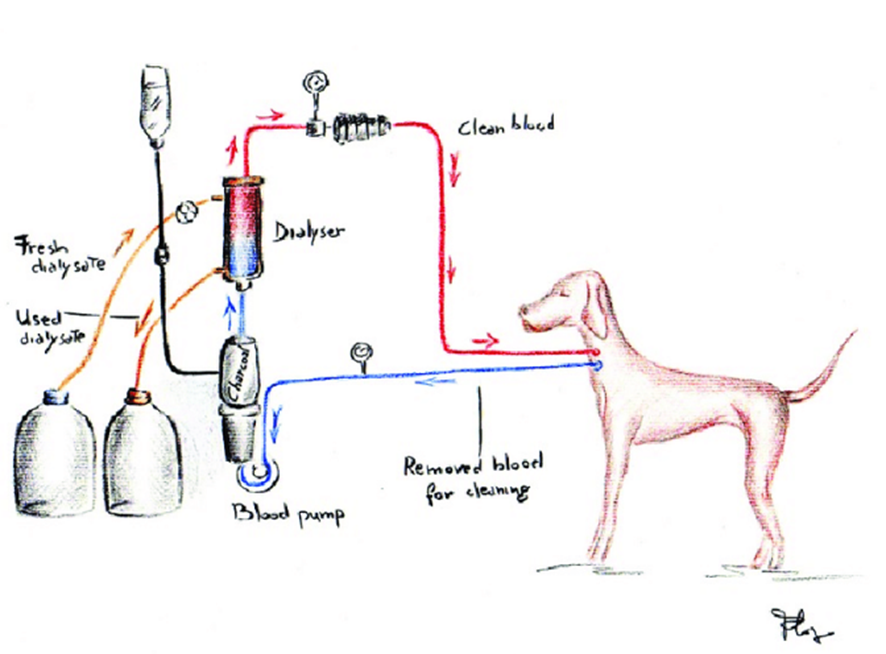



Nenhum comentário:
Postar um comentário